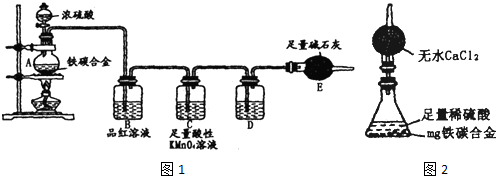
题目内容
|
将7.8 g铁加入200 mL 2 mol·L-1的HNO3溶液中,充分反应后,溶液中主要离子的浓度关系是 | |
| [ ] | |
A. |
c(NO3-)>c(Fe2+)>c(Fe3+)>c(H+) |
B. |
c(NO3-)>c(Fe3+)>c(Fe2+)>c(H+) |
C. |
c(Fe2+)>c(Fe3+)>c(NO3-)>c(H+) |
D. |
c(Fe2+)>c(NO3-)>c(Fe3+)>c(H+) |
解析:
|
Fe有 在Fe+4HNO3 |

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案|
将7.8 g铁加入到200 mL 2 mol·L-1的HNO3溶液中,充分反应后,溶液中主要离子的浓度关系是( ). | |
A. |
c(NO3-)>c(Fe2+)>c(Fe3+)>c(H+) |
B. |
c(NO3-)>c(Fe3+)>c(Fe2+)>c(H+) |
C. |
c(Fe2+)>c(Fe3+)>c(NO3-)>c(H+) |
D. |
c(Fe2+)>c(NO3-)>c(Fe3+)>c(H+) |
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
| | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
| | 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)
 Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2( OH-) = 5.6×10-12Ca(OH)2(s)
 Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-) = 4.7×10-6若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。