题目内容
氯气在25℃、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有
与水反应.请回答下列问题:
(1)该反应的离子方程式为 ;
(2)估算该反应的平衡常数为 (利用离子方程式计算);
(3)在上述平衡体系中加入少量KOH固体,平衡将 (填“向正反应方向”、“向逆反应方向”或“不”)移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将 (填“增大”、“减小”或“不变”),平衡将 (填“向正反应方向”、“向逆反应方向”或“不”)移动.
| 1 |
| 3 |
(1)该反应的离子方程式为
(2)估算该反应的平衡常数为
(3)在上述平衡体系中加入少量KOH固体,平衡将
(4)如果增大氯气的压强,氯气在水中的溶解度将
考点:氯气的化学性质
专题:
分析:(1)氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质;
(2)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;结合平衡计算平衡状态微粒的浓度,依据平衡常数概念计算得到;
(3)加入氢氧化钠,溶液中的氢氧根离子,和氢离子反应,平衡正向进行;
(4)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行.
(2)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;结合平衡计算平衡状态微粒的浓度,依据平衡常数概念计算得到;
(3)加入氢氧化钠,溶液中的氢氧根离子,和氢离子反应,平衡正向进行;
(4)气体溶解度随压强增大会增大,平衡向气体体积减小的方向进行.
解答:
解:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO,故答案为:Cl2+H2O?H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;依据平衡三段式列式计算得到平衡浓度:
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=
=4.5×10-4
故答案为:4.5×10-4;
(3)在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,故答案为:正反应方向;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,故答案为:增大;正反应方向.
(2)在1L水中可溶解0.09mol氯气,近似氯气难度为0.09mol/L;依据平衡三段式列式计算得到平衡浓度:
Cl2+H2O?H++Cl-+HClO
起始浓度:0.09 0 0 0
转化浓度:0.03 0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03 0.03
K=
| 0.03×0.03×0.03 |
| 0.06 |
故答案为:4.5×10-4;
(3)在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,故答案为:正反应方向;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,平衡都向正反应方向移动,氯气的溶解量会增加,故答案为:增大;正反应方向.
点评:本题考查了氯气性质,化学平衡的影响因素影响,平衡计算应用,Cl2溶于水的离子反应方程式;平衡常数的计算;浓度对反应平衡的移动影响;压强对平衡移动的影响判断是解题关键.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
石墨和金刚石都是碳的单质,1mol石墨在一定条件下可完全转化为金刚石,要吸收QKJ的能量,下列说法正确的是( )
| A、石墨不如金刚石稳定 |
| B、等质量的石墨与金刚石相比,石墨具有的能量高 |
| C、等物质的量的石墨与金刚石完全燃烧,金刚石放出的能量多 |
| D、等物质的量的石墨与金刚石完全燃烧,石墨放出的能量多 |
下列分子式表示的物质一定是纯净物的是( )
| A、CH2O |
| B、C2H6O |
| C、C3H7Cl |
| D、C2H4Cl2 |
下列关于氯水的叙述,正确的是( )
| A、新制氯水中只含Cl2和H2O分子 |
| B、新制氯水可使蓝色石蕊试纸先变红后褪色 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后酸性会减小 |
在苯和苯酚组成的混合物中,碳元素的质量分数为90% 则混合物中氧元素的质量分数为( )
| A、2.5% | B、5% |
| C、6.5% | D、7.5% |
如图为一“链环”图案,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.下列分类依据错误的是( )
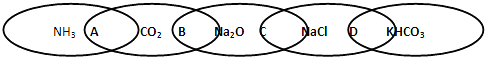

| A、两种物质都是电解质 |
| B、两种物质都是氧化物 |
| C、两种物质都是钠的化合物 |
| D、两种物质都是盐 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
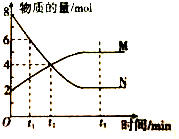

| A、反应的化学方程式:2N?M |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、反应开始时只投入了N |