题目内容
14.在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如表.下列判断正确的是( )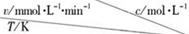 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=7.50 | |
| B. | 同时改变反应温度和蔗糖的浓度,v可能不变 | |
| C. | b>318.2 | |
| D. | 温度为b时,蔗糖浓度减少一半所需的时间比318.2K时短 |
分析 A、由表可知温度由318.2→328.2℃,在浓度相同的情况下$\frac{{v}_{318.2}}{{v}_{328.2}}$=0.4,由此解答;
B、由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等;
C、由表可知温度由328.2℃→b,在浓度相同的情况下,水解速率变小,所以温度降低;
D、温度越高反应速率越快,所以蔗糖浓度减少一半所需的时间不同,温度高的所需时间短.
解答 解:A、由表可知温度由318.2→328.2℃,在浓度相同的情况下$\frac{{v}_{318.2}}{{v}_{328.2}}$=0.4,所以a=$\frac{2.4}{0.4}$=6,故A错误;
B、由表可知温度由318.2℃→b,浓度由0.3mol/L→0.5mol/L,速率相等,都是1.80,所以v可能不变,故B正确;
C、由表可知温度由328.2℃→b,在浓度相同的情况下,水解速率变小,所以温度降低,所以温度b<318.2,故C错误;
D、温度越高反应速率越快,所以蔗糖浓度减少一半所需的时间不同,温度高的所需时间短,故D错误;
故选B.
点评 本题考查较综合,涉及反应速率计算、影晌速率的因素分析等,侧重学生表格数据分析及计算能力的考查,注重对高考高频考点的训练,题目难度中等.

练习册系列答案
相关题目
4.下图是元素周期表的一部分,表中的①-⑩中元素,用化学用语填空回答:
(1)在这些元素中,⑩原子的原子结构示意图为 ;
;
(2)用电子式表示③与④形成化合物的过程 ;
;
(3)①的单质和⑥的氧化物反应的化学方程式2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)写出⑤的氢氧化物与氢氧化钡溶液反应的离子方程式:Al(OH)3+OH-=AlO-2+2H2O;
(5)已知拆开l mol C-H键、l mol O═O键、l molC=O键、l mol H-O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ.则l mol甲烷完全燃烧放出660kJ的热量.
(6)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)--空气燃料电池作为电源,则放电时的负极反应式N2H4-4e-+4OH-═N2+4H2O(生成物均无污染)
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 四 | ⑨ | ⑩ |
 ;
;(2)用电子式表示③与④形成化合物的过程
 ;
;(3)①的单质和⑥的氧化物反应的化学方程式2C+SiO2 $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)写出⑤的氢氧化物与氢氧化钡溶液反应的离子方程式:Al(OH)3+OH-=AlO-2+2H2O;
(5)已知拆开l mol C-H键、l mol O═O键、l molC=O键、l mol H-O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ.则l mol甲烷完全燃烧放出660kJ的热量.
(6)假设用以铂做电极,KOH溶液为电解质溶液的肼(N2H4)--空气燃料电池作为电源,则放电时的负极反应式N2H4-4e-+4OH-═N2+4H2O(生成物均无污染)
5.为检验某待测液中SO42-,所加试剂及顺序正确的是( )
| A. | 先加BaCl2,再加入HCl | B. | 先加HNO3,再加BaCl2 | ||
| C. | 先加H2SO4,再加BaCl2 | D. | 先加HCl,再加BaCl2 |
2.2011年10月23日,土耳其因发生7.2级地震而使当地的饮用水受污染.医疗救助人员打算给当地居民提供一些关于饮用水处理的建议,下列建议不合理的是( )
| A. | 用明矾使悬浮颗粒沉降下来 | B. | 用漂白粉进行消毒杀菌 | ||
| C. | 只要无色透明,就可以放心饮用 | D. | 饮用前加热煮沸 |
6.从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制 碘的说法,正确的是( )
干海带$\stackrel{灼热}{→}$海带灰$→_{浸泡}^{沸水}$悬浊液$\stackrel{过滤}{→}$滤液$\underset{\stackrel{{H}^{+}}{→}}{{H}_{2}{O}_{2}}$碘水$\stackrel{CCl_{4}}{→}$I2的CCl4溶液$\stackrel{蒸馏}{→}$I2.
干海带$\stackrel{灼热}{→}$海带灰$→_{浸泡}^{沸水}$悬浊液$\stackrel{过滤}{→}$滤液$\underset{\stackrel{{H}^{+}}{→}}{{H}_{2}{O}_{2}}$碘水$\stackrel{CCl_{4}}{→}$I2的CCl4溶液$\stackrel{蒸馏}{→}$I2.
| A. | 实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌 | |
| B. | 可用酒精萃取碘水中的I2 | |
| C. | 在碘水中加入几滴淀粉溶液,溶液变蓝色 | |
| D. | 含I-的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应 |
3. 锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
 锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过.下列有关叙述不正确的是( )| A. | Zn电极上发生氧化反应 | |
| B. | 电子的流向为Zn→电流表→Cu | |
| C. | SO42-由乙池通过离子交换膜向甲池移动 | |
| D. | 电池工作一段时间后,乙池溶液的总质量明显增加 |
4.X、Y、Z是短周期三种元素,它们在周期表中的位置如图所示.试回答:
(1)X元素单质的化学式是He.
(2)Z元素的原子结构示意图为 .
.
(3)Y在元素周期表中的位置是第二周期、ⅤⅡA族.
(4)与Z同主族的下一周期元素的原子序数是34.
| X | ||
| Y | ||
| Z |
(2)Z元素的原子结构示意图为
 .
.(3)Y在元素周期表中的位置是第二周期、ⅤⅡA族.
(4)与Z同主族的下一周期元素的原子序数是34.
 烯烃A在一定条件下可以按下面的框图进行反应.
烯烃A在一定条件下可以按下面的框图进行反应.