题目内容
【题目】已知AG=lg![]() ,电离度α=
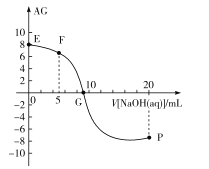
,电离度α=![]() ×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
×100%。常温下,向10mL0.1mol/LHX溶液中滴加0.1mol/LNaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。
下列说法错误的是( )
A.F点溶液pH<7
B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)<c(HX)
D.常温下,HX的电离度约为1%
【答案】C
【解析】
E点为0.1mol/LHX溶液,AG=lg![]() =8,则
=8,则![]() =108,水的离子积KW=
=108,水的离子积KW=![]() =10-14,由此计算氢离子浓度;
=10-14,由此计算氢离子浓度;
F点为等物质的量HX溶液NaX溶液的混合液,此时AG=lg![]() =6,则c(H+)>c(OH-),pH<7;
=6,则c(H+)>c(OH-),pH<7;
G点为AG=lg![]() =0,则c(H+)=c(OH-);
=0,则c(H+)=c(OH-);
V=10时溶液为NaX溶液,由于水解和水的电离c(OH-)>c(HX)。
A. F点为等物质的量HX溶液NaX溶液的混合液,此时AG=lg![]() =6,则c(H+)>c(OH-),pH<7,故A正确;
=6,则c(H+)>c(OH-),pH<7,故A正确;
B. G点溶液中AG=lg![]() =0,则c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+ c(Na+)=c(OH-)+ c(X-),故c(Na+)=c(X-)>c(H+)=c(OH-),故B正确;
=0,则c(H+)=c(OH-),溶液中存在电荷守恒c(H+)+ c(Na+)=c(OH-)+ c(X-),故c(Na+)=c(X-)>c(H+)=c(OH-),故B正确;
C.V=10时溶液为NaX溶液,由于水解和水的电离c(OH-)>c(HX),故C错误;
D.E点为0.1mol/LHX溶液,AG=lg![]() =8,则
=8,则![]() =108,水的离子积KW=
=108,水的离子积KW=![]() =10-14,
=10-14, ![]() ,则电离度=
,则电离度=![]() ,故D正确;
,故D正确;
故答案选:C。

【题目】在不同条件下进行化学反应![]() ,B、D起始浓度均为0,反应物A的浓度
,B、D起始浓度均为0,反应物A的浓度![]() 随反应时间的变化情况如下表:下列说法不正确的是( )
随反应时间的变化情况如下表:下列说法不正确的是( )
序号 | 时间 温度 | 0 | 20 | 40 | 50 |
① | 800 |
|
|
|
|
② | 800 | x |
|
|
|
③ | 800 | y |
|
|
|
④ | 820 |
|
|
|
|
A.①中B在![]() min平均反应速率为
min平均反应速率为![]()
![]()
B.②中![]() ,可能使用了催化剂
,可能使用了催化剂
C.③中![]()
![]()
D.比较①④可知,该反应为吸热反应