题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A元素的原子只有一个电子层,又知A与C、B与D分别属于同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的二倍,又知四种元素的单质常温常压下有两种气体、两种固体。请回答下列问题:
(1)D元素在元素周期表中的位置: 。
(2)B元素比D元素的非金属性强的依据是 (填序号)。
a.两元素组成的化合物中D元素为正价 b.单质的熔沸点的高低
c.最高价氧化物对应的水化物的酸性强弱 d.气态氢化物的稳定性
(3)由A、B、D三种元素中的两种可分别形成甲、乙两种离子,它们均为负一价双原子核的阴离子,且甲离子含有18个电子,乙离子含有10个电子,则甲与乙反应的离子方程式为 。
(4)写出C和D两元素的最高价氧化物对应的水化物在稀溶液里反应的热化学方程式: (已知此反应生成1 molH2O时放出的热量为57.3 kJ)。
(5)用A元素的单质与B元素的单质可以制成燃料电池,燃料电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,在M极通入A的单质,N极通入B的单质,则N极的电极反应式为: 。
(1)第三周期ⅥA族
(2)a、d
(3)HS-+OH-=S2-+H2O
(4)H2SO4(aq)+2NaOH(aq)=Na2SO4(aq) +2H2O(l) △H=−114.6kJ·mol-1
(5)O2+2H2O+4e-=4OH-
【解析】
试题分析:A、B、C、D分别为H、O、Na、S。(2)元素非金属性的强弱判断可以根据其与氢气化合的能力、氢化物的稳定性、最高价氧化物对应水化物酸性等;(3)甲为HS-,乙为OH-,它们之间发生中和反应;(5)氢氧燃料电池,氢气在负极失去电子,氧气在正极得到电子,在碱性介质电极反应式为O2+2H2O+4e-=4OH- 。
考点:考查物质结构与元素周期律有关问题。

 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为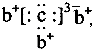 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
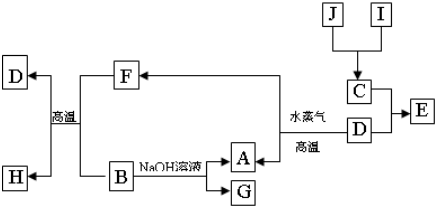
 Al(OH)3+OH-
Al(OH)3+OH-