题目内容
(1)为什么离子化合物都是强电解质?(2)氯化铝是离子化合物还是共价化合物,是强电解质还是弱电解质?(3)酸式盐是强电解质还是弱电解质?
(1)离子化合物本来就是由离子组成的,在离子化合物中不存在分子。离子化合物无论是溶于水还是熔化状态,都是以离子的形式存在,而不存在分子。即离子化合物溶于水或受热熔化以后,都完全电离为自由移动的离子,故离子化合物都是强电解质。
(2)氯化铝是共价化合物,而不是离子化合物,它是强电解质,原因是氯化铝在水溶液中的电离是完全电离。
(3)碳酸氢钠、硫酸氢钠等酸式盐,一般为强电解质,因为它们的电离是完全电离,如碳酸氢钠溶于水后的电离:NaHCO3====Na++![]() (易);
(易);![]()
![]() H++
H++![]() (难)。硫酸氢钠溶于水后的电离:NaHSO4====Na++ H++
(难)。硫酸氢钠溶于水后的电离:NaHSO4====Na++ H++![]() ;硫酸氢钠受热熔化后的电离:NaHSO4====Na++
;硫酸氢钠受热熔化后的电离:NaHSO4====Na++![]() 。
。

练习册系列答案
相关题目
 Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3·5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3 易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。


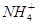 +
+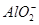 +2H2O
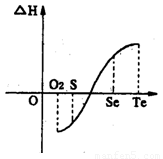
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
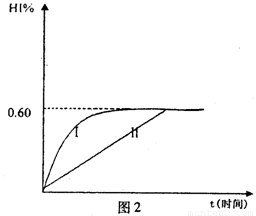
Al(OH)3↓ +NH3·H2O,向含有等物质的量的 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示: