题目内容
【题目】下列有关描述正确的是
A.第一电离能:B>Be>Li
B.键角:BF3>CH4>H2O>NH3
C.CO2、HClO、HCHO分子中一定既有σ键又有π键
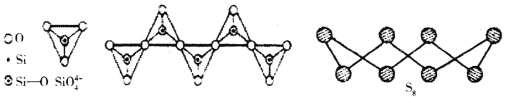
D.在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图,其中Si原子的杂化方式与图中S8单质中S原子的杂化方式相同
【答案】D
【解析】
A. 第一电离能:同周期从左到右,第一电离能呈现增大的趋势,但是出现半充满和全充满的元素,会高于相邻元素的第一电离能,Be元素最外层为全充满结构,较稳定,第一电离能大于同周期相邻元素,所以第一电离能:Be > B >Li,故A错误;
B.分子的立体构型; BF3为平面三角形,键角为120°,CH4 为正四面体,其键角为109°28′,NH3为三角锥形,键角为107°,H2O为V型,其键角为104°,所以键角:BF3>CH4>NH3>H2O,故B错误;
C. CO2含有C=O,所以分子中含有σ键和π键,HCHO(甲醛)的结构式中含有C-H、C=O键,其分子中含有σ键和π键,而HClO中只存在共价单键,只存在σ键,故C错误;
D. 硅酸盐中的SiO44-为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;S8单质中S原子有2个孤电子对和2个共价键,杂化方式也是sp3,故D正确;
答案选D。

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目