题目内容
19.(1)请用下列几种物质的序号填空:①MgCl2 ②Na2S ③NH4NO3 ④K2O2 ⑤Ca(OH)2 ⑥Na2CO3 ⑦SiF4
既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤⑥.
(2)X、Y是构成上述物质元素中的两种,能形成XY2型化合物,已知XY2中共有38个电子,若XY2为离子化合物,用电子式表示XY2的形成过程
 ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.
分析 (1)一般来说,金属元素与非金属元素形成离子键,非金属元素形成共价键,同种非金属元素之间形成非极性共价键,不同非金属元素形成极性键;
(2)XY2中共有38个电子,$\frac{38}{3}$≈12,应存在第二周期元素,若XY2为离子化合物,Y为F,X为Ca,应为CaF2;若XY2为共价化合物时,X为C,Y为S,以此来解答.
解答 解:(1)①MgCl2中只含离子键;
②Na2S中只含离子键;
③NH4NO3中含离子键和极性共价键;
④K2O2中含离子键和O-O非极性键;
⑤Ca(OH)2中含离子键和极性共价键;
⑥Na2CO3中含离子键和极性共价键;
⑦SiF4中只含极性共价键,
既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤⑥,故答案为:④; ③⑤⑥;
(2)XY2中共有38个电子,$\frac{38}{3}$≈12,应存在第二周期元素,若XY2为离子化合物,Y为F,X为Ca,应为CaF2用电子式表示XY2的形成过程为 ;若XY2为共价化合物时,X为C,Y为S,化合物为CS2,其电子式为
;若XY2为共价化合物时,X为C,Y为S,化合物为CS2,其电子式为 ,
,
故答案为: ;
; .
.
点评 本题考查化学键,为高频考点,把握化学键的形成及化学键判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
9.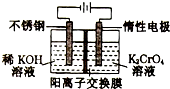 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如下,下列说法不正确的是( )| A. | 在阳极室,通电后溶液逐渐由黄色变为橙色 | |
| B. | 在阴极室,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| C. | 若测得右室中K与Cr的物质的量之比($\frac{nk}{ncr}$)为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比($\frac{nk}{ncr}$)为d,则此时铬酸钾的转化率为2-d |
10. 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
 甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )| A. | 若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2 | |
| B. | 若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物 | |
| C. | 若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用 | |
| D. | 若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊 |
7.某元素二价阴离子的核外有18个电子,质量数为34,该元素的原子核中的中子数为( )
| A. | 16 | B. | 18 | C. | 20 | D. | 22 |
14.观察分析,符合图中变化的化学反应为( )


| A. | A2+3B2═2AB3 | B. | 2AB2+B2═2AB3 | C. | 2A2B+5B2=4AB3 | D. | 2AB2+B2=2AB3 |
4.在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量变小的是( )
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
①H+的物质的量浓度
②OH-的物质的量浓度
③c(CH3COO-)/c(CH3COOH)
④c(H+)•c(OH-)
| A. | ①② | B. | ② | C. | ②③ | D. | ②③④ |
11.下列叙述中,正确的是( )
| A. | 在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 | |
| B. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| C. | 在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 | |
| D. | 在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |
1.已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-Q1 kJ•mol-12H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ•mol-12H2(g)+O2(g)═2H2O(l)△H=-Q3 kJ•mol-1常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(标准状况)经完全燃烧后恢复到常温,则放出的热量为( )
| A. | (0.4 Q1+0.05 Q3) kJ | B. | (0.4 Q1+0.05 Q2) kJ | ||
| C. | (0.4 Q1+0.1 Q3) kJ | D. | (0.4Q1+0.2 Q1) kJ |
 .
.