题目内容
(双选)在1 L密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
4NO(g)+6H2O(g) △H=-Q kJ·mol-1(Q>O),容器内部分物质的物质的量浓度如下表:
|
时间 |
c(NH3) (mol/L) |
c(O2 ) (mol/L) |
c(NO) (mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.7 |
1.475 |
0.1 |
|
第10min |
0.7 |
1.475 |
0.1 |
下列说法错误的是
A.反应在第2 min到第4min时,O2 的平均反应速率为0.1875 mol/(L·min)
B.反应在第2 min时改变了某一条件,该条件可能是使用催化剂或升高温度
C.第4 min时、第8 min时分别达到化学平衡,且平衡常数不相同
D.在开始反应的前2 min内,该反应的△H=-0.05Q kJ·mol-1
BD
【解析】
试题分析:先由△c÷△t的定义式直接求v(NH3)或v(NO),再由系数比规律间接求v(O2),则v(O2)=0.3mol/L÷2min×5/4=0.1875 mol/(L·min),故A正确;催化剂能加快反应速率,使c(NH3)的消耗速率增大,虽然升温也能加快反应速率,但也能使平衡左移,使c(NH3)增大,故B错误;第4 min时、第8 min时分别达到化学平衡,由于c(H2O)=6c(NO)/4,则平衡常数分别为(0.54×0.756)/(0.34×0.9755)、(0.14×0.156)/(0.74×1.4755),前者大于后者,故C正确;在开始反应的前2 min内,△c(NH3)=0.2mol/L,则消耗0.2mol NH3,设放出的热量为xkJ,所以4/0.2=Q/x,则x=0.05Q,因此该反应的△H仍是-Q kJ·mol-1,故D错误。
考点:考查化学反应速率的计算、影响化学反应速率和化学平衡的因素、化学平衡常数的计算、化学反应的焓变与热量变化等知识。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A、Z为0.3mol.L-1, | B、X2为0.2mol.L-1, | C、Y2为0.3mol.L-1, | D、Z为0.4mol.L-1, |
 浓度
浓度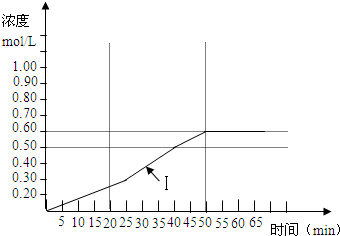
 CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题:
CH3OH(g) + H2O(g) ΔH=-187.4 kJ/mol。3000C时的恒容密闭容器中,当C(CO2) = 1.00 mol.L-1 C(H2) =" 1.60" mol.L-1开始反应,结果如右图所示,回答下列问题: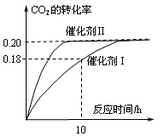
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。