题目内容
16.将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20g.等物质的量的此有机物与足量金属Na反应在标准状况下产生2.24L气体,则此有机物为( )| A. | 乙烯 | B. | 乙二醇 | C. | 乙醇 | D. | 乙酸 |
分析 有机物燃烧完全燃烧生成CO2和H2O,通过足量的石灰水,发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,得到沉淀20g为CaCO3质量,有机物与Na反应生成氢气,含有羟基或羧基,结合生成氢气的体积计算.
解答 解:有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀20g,应为CaCO3,
n(CO2)=n(CaCO3)=$\frac{20g}{100g/mol}$=0.2mol,
等物质的量的此有机物与足量金属Na反应在标准状况下产生2.24L气体,即n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,应含有羟基或羧基,
由转化关系-OH(-COOH)~H2,可知有机物中C原子数与羟基或羟基的物质的量之比为1:1,
只有乙二醇符合.
故选B.
点评 本题考查有机物的推断,侧重考查学生的分析、计算能力,为高频考点,注意把握物质的性质以及反应的关系,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
6.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中( )
| A. | 该反应中转移电子数为16NA | |
| B. | 氧化产物与还原产物的粒子个数比为2:5 | |
| C. | 氧化剂与还原剂物质的量之比为1:8 | |
| D. | 氧化剂与还原剂物质的量之比为1:5 |
7.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、CO32-、OH- | C. | OH-、Cl-、CO32- | D. | Cl-、OH-、CO32- |
4.海水开发利用的部分过程如图所示.下列说法错误的是( )


| A. | 向苦卤中通入Cl2前,可先用稀硫酸酸化 | |
| B. | 工业生产中常选用KOH作为沉淀剂 | |
| C. | 粗盐可采用除杂和重结晶等过程提纯 | |
| D. | 富集溴可用热空气吹出单质溴,原因是溴单质沸点低,易挥发 |
11.下列有关醛的判断正确的是( )
| A. | 用溴水检验CH2=CH-CHO中是否含有碳碳双键 | |
| B. | 1mol醛发生银镜反应最多生成2molAg | |
| C. | 对甲基苯甲醛( )使高锰酸钾酸性溶液褪色,说明它含醛基 )使高锰酸钾酸性溶液褪色,说明它含醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
1.现有失去标签的氯化镁、碳酸钠、硫酸氢钠、氢氧化钡四种无色溶液,为了确定四种溶液各是什么,将它们随意编号A、B、C、D后进行实验,其实验现象如表
根据实验现象,按要求回答:
(1)写出各物质的化学式ABa(OH)2、BNaHSO4、CNa2CO3、DMgCl2
(2)写出实验中反应②的离子方程式2H++CO32-=CO2↑+H2O向A中滴加少量的B的离子方程式H++SO42-+OH-+Ba2+=BaSO4↓+H2O,继续滴加的离子方程式H++OH-=H2O.
| 反应编号 | 反应物质 | 有关现象 |
| ① | A+B | 有沉淀生成 |
| ② | B+C | 有气体放出 |
| ③ | C+D | 有沉淀生成 |
| ④ | B+D | 无明显现象 |
| ⑤ | A+D | 有沉淀生成 |
(1)写出各物质的化学式ABa(OH)2、BNaHSO4、CNa2CO3、DMgCl2
(2)写出实验中反应②的离子方程式2H++CO32-=CO2↑+H2O向A中滴加少量的B的离子方程式H++SO42-+OH-+Ba2+=BaSO4↓+H2O,继续滴加的离子方程式H++OH-=H2O.
8.下列各组离子在溶液中一定能大量共存的是( )
| A. | 使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- | |
| B. | 含有较多CO32-的溶液中:K+、Fe3+、SO42-、NO3- | |
| C. | 水电离产生的氢离子浓度为10-11mol/L:K+、Ca2+、HCO3-、NO3- | |
| D. | 存在较多的AlO2-的溶液中:Mg2+、Ba2+、Br-、HCO3- |
5.某元素一价阴离子的核外有18个电子,质量数为35,该微粒符号可表示为( )
| A. | ${\;}_{18}^{35}$Cl- | B. | ${\;}_{17}^{35}$Cl | C. | ${\;}_{19}^{35}$Cl- | D. | ${\;}_{17}^{35}$Cl- |
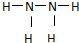 ,过氧化氢的电子式
,过氧化氢的电子式 .
.