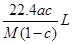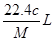题目内容
由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比不可能为
| A.39:24:13 | B.22:7:14 | C.13:8:29 | D.26:16: 57 |
B
解析试题分析:同温同压下密度之比等于摩尔质量之比,CO的摩尔质量与N2的相同,所以只要求出CO2和H2的平均摩尔质量是28g/mol即可。方法一:(44nCO2+2n H2) / (nCO2+n H2)="28" 所以nCO2 / nH2=13:8,因此应选B。
考点:阿伏伽德罗定律的推论。

练习册系列答案
相关题目
下列选项中所涉及的两个量一定相等的是
| A.11.2 L N2与14 g CO气体所含有的原子数 |
| B.电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C.6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D.18 g重水(D2O)与17 g NH4+所含有的电子数 |
同温同压下,相同体积的下列气体,质量最大的是
| A.O2 | B.CH4 | C.CO2 | D.H2S |
由以下两种途径制铜:(1)CuO CuSO4
CuSO4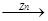 Cu (2)Zn
Cu (2)Zn H2
H2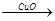 Cu 假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是
Cu 假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是
| A.消耗等物质的量的Zn、H2SO4、CuO |
| B.所有反应类型都相同 |
| C.过程中产生的ZnSO4质量相同 |
| D.只有CuO消耗的质量相同 |
一定温度和压强下,30 L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
| A.该温度和压强可能是标准状况 |
| B.该气体中每个分子含有2个原子 |
| C.若O2在该条件下为气态,则1 mol O2在该条件下的体积也为30 L |
| D.标准状况下该纯净物若为气态,其体积约是22.4 L |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1 mol羟基所含的电子总数为10NA |
| B.标准状况下,1L正戊烷完全燃烧所生成的CO2分子数为5NA/22.4 |
| C.4.2g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8NA |
下列溶液与20mL 1 mol·L–1 NaNO3溶液中NO3–物质的量浓度相等的是( )
| A.10 mL 0.5 mol·L–1 Cu(NO3)2溶液 | B.5 mL 0.8 mol·L–1 Al(NO3)3溶液 |
| C.10 mL 2 mol·L–1 AgNO3溶液 | D.10 mL 1 mol·L–1 Mg(NO3)2溶液 |
某溶液中大量存在以下五种离子:NO 、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO
、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO )︰n(SO42—)︰n(Fe3+)︰n(H
)︰n(SO42—)︰n(Fe3+)︰n(H )︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的
)︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的
| A.Fe2+ | B.Cu2+ | C.Al3+ | D.Ba2+ |
 )溶于ag水中,所得溶液的密度为
)溶于ag水中,所得溶液的密度为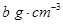 ,物质的量浓度为
,物质的量浓度为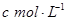 ,则该气体溶入水中的体积是
,则该气体溶入水中的体积是