题目内容
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
 ⑴写出该反应的平衡常数表达式:K= 。
⑴写出该反应的平衡常数表达式:K= 。
已知:![]() >
>![]() ,则该反应是 热反应。
,则该反应是 热反应。
⑵右图中表示NO2的变化的曲线是 。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
⑴K=c2(NO2)/c2 (NO) c(O2) 放热
⑵b 1.5×10-3mol·L-1·s-1
⑶b c
⑷c
解析:
(1)由根据平衡常数的公式进行书写。由![]() >
>![]() 说明降低温度,平衡向正反应方向,可知正反应为放热反应。
说明降低温度,平衡向正反应方向,可知正反应为放热反应。
(2)NO2的起始浓度为c(NO2)=0,2s时c(NO2)可根据图表中n(NO)变化量求解,c(NO2)=(0.02-0.008)mol/2=0.006mol/L,故答案选b。由图表可求0~2s内v(NO)=(0.02-0.008)mol/2L.2s=0.003 mol·L-1·s-1,故v(O2)= 1.5×10-3mol·L-1·s-1.
(3)a:在任意状态下,都存在这样的速率关系,故不能作为平衡状态的标志。
b:因该反应为气体体积不等的反应,故压强不变可作平衡状态的标志。
c:由v逆 (NO)=2v正(O2),可推出v逆 (NO)= v正(NO),说明已达平衡状态。
d.由于平衡体系中全是气体,容器体积固定,故任意状态下密度不变,故d错。
(4)及时分离除NO2气体,只能使平衡向正反应移动,不能增大反应速率,故a错;因该反应为放热反应,升温虽使反应速率增大,但平衡向逆反应方向移动,故b错;催化剂只能增大反应速率,不能改变化学平衡的移动的方向,故d错。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案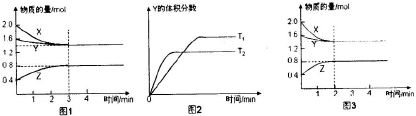
| A、反应进行的前3min内,用X表示的反应速率V(X)=0.1mol/(L?min) | B、平衡时容器内的压强为反应前的0.8倍 | C、保持其他条件不变,升高温度,反应的化学平衡常数K减小 | D、若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
| 时间/s | 1 | 2 | 3 | 4 | |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
(1)用A浓度变化表示从0~2s内该反应的平均速率v= mol/.
(2)能说明该反应已达到化学平衡状态的是 (填序号).
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是 (填“吸热”或“放热”)反应.
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是 .