题目内容
14.下列有关仪器的使用或操作正确的是( )| A. | 烧杯、烧瓶、锥形瓶均可加垫石棉网加热 | |
| B. | 试剂瓶可以用于存放、溶解、稀释药品 | |
| C. | 用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线 | |
| D. | 用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确 |
分析 A.烧杯、烧瓶和锥形瓶属于间接加热仪器;
B.试剂瓶只能用于存放药品;
C.用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至离刻度线1-2cm处;
D.用滴定管量取液体时,开始读数和最后读数均俯视,会导致量取液体体积偏小.
解答 解:A.烧杯、烧瓶和锥形瓶属于间接加热仪器,所以烧杯、烧瓶、锥形瓶均可加垫石棉网加热,故A正确;
B.试剂瓶只能用于存放药品,不能溶解或稀释药品,故B错误;
C.用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至离刻度线1-2cm处,然后改用胶头滴管滴加,故C错误;
D.用滴定管量取液体时,开始读数和最后读数均俯视,会导致量取液体体积偏小,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及仪器的使用、溶液配制,明确仪器作用及基本操作方法是解本题关键,注意滴定管刻度特点,为易错点.

练习册系列答案
相关题目
4.下列溶液中各微粒的浓度关系正确的是( )
| A. | pH=4的盐酸中:c(H+)=4.0mol•L-1 | |
| B. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| C. | NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
5.下列叙述正确的是( )
| A. | 乙醇能使酸性KMn04溶液和酸性K2Cr207溶液褪色,均被氧化成乙酸 | |
| B. | 向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小 | |
| C. | 向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在S042-或S032- | |
| D. | 实验室提纯混有少量氯化钠的硝酸钾,通常采用重结晶的方法 |
2.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| B. | 1 L 1 mol•L-1氨水中,NH4+和OH-总数为2NA | |
| C. | 常温常压下,6 0g 二氧化硅含有的氧原子数目为2NA | |
| D. | 22.4LCl2与足量的FeCl2溶液充分反应转移的电子数为2NA |
19.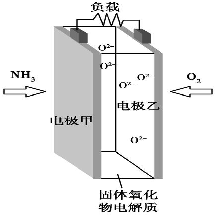 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为4NH3+5O2═4NO+6H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
6.能区分胶体和溶液的方法是( )
| A. | 静置,有沉淀现象的是胶体 | B. | 能透过滤纸的是溶液 | ||
| C. | 用肉眼观察,均匀透明的是溶液 | D. | 有丁达尔现象的是胶体 |
4.用惰性电极电解2L 1mol•L-1的硫酸铜溶液,在电路中通过0.5mol电子后,将电源反接,电路中又通过1mol电子,此时溶液中c(H+)是(设溶液体积不变)( )
| A. | 1.5 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.75 mol•L-1 | D. | 0.25 mol•L-1 |