题目内容
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,则该样品中c(H+)=_____________,该样品放置一段时间后,酸性略有增强,其原因可能是________________________________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
【答案】< 5.6 SO2+H2O![]() H2SO3 2H2SO3 + O2 → 2H2SO4 10—5mol/L 酸雨中的亚硫酸被氧化成硫酸了 燃料脱硫(合理即可) 取样于试管中,先滴加盐酸无现象,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42- 。
H2SO3 2H2SO3 + O2 → 2H2SO4 10—5mol/L 酸雨中的亚硫酸被氧化成硫酸了 燃料脱硫(合理即可) 取样于试管中,先滴加盐酸无现象,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42- 。
【解析】
随着工业的发展,酸雨已经称为全球性的环境问题。
⑴由于雨水中含有溶液的二氧化硫生成亚硫酸,因此当雨水的pH< 5.6,我们称它为酸雨,故答案为< 5.6;
⑵用化学方程式来表示酸雨形成的主要途径有两种,一种的雨水和二氧化硫反应生成亚硫酸,亚硫酸与空气中氧气反应生成硫酸,另一种途径为二氧化硫在空气中飘尘的作用下与氧气反应生成三氧化硫,三氧化硫与雨水反应生成硫酸,前者的反应方程式为SO2+H2O![]() H2SO3,2H2SO3 + O2 == 2H2SO4,故答案为:SO2+H2O
H2SO3,2H2SO3 + O2 == 2H2SO4,故答案为:SO2+H2O![]() H2SO3,2H2SO3 + O2 == 2H2SO4;
H2SO3,2H2SO3 + O2 == 2H2SO4;
⑶常温下测得某次酸雨样品的pH=5,则该样品中![]() ,因此c(H+)=1×10-5 mol/L,该样品放置一段时间后,酸性略有增强,亚硫酸酸性弱,而强酸酸性强,其原因可能是酸雨中的亚硫酸被氧化成硫酸了,故答案为:可能是酸雨中的亚硫酸被氧化成硫酸了;
,因此c(H+)=1×10-5 mol/L,该样品放置一段时间后,酸性略有增强,亚硫酸酸性弱,而强酸酸性强,其原因可能是酸雨中的亚硫酸被氧化成硫酸了,故答案为:可能是酸雨中的亚硫酸被氧化成硫酸了;
⑷写出一条减少二氧化硫排放的措施有用氨水吸收尾气,双碱脱硫,燃料脱硫等,故答案为:燃料脱硫(合理即可);
⑸检验某无色溶液中是否存在SO42-的方法是取样于试管中,先滴加盐酸无现象,滴加盐酸主要目的是排出银离子、碳酸根、亚硫酸根等离子的干扰,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-,故答案为:取样于试管中,先滴加盐酸无现象,再滴加BaCl2溶液,出现白色沉淀,说明有SO42-,如无沉淀,则不存在SO42-。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案【题目】能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=__________kJmol-1
CH3OH(g) △H=__________kJmol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池______极,B极的电极反应式为_________________________________。
(3)参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是 ___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
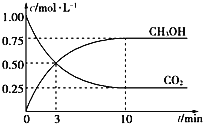
①该反应的平衡常数表达式为K=_______;从反应开始到10min,v(H2)=_____mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有__ (填字母)
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度_______(填“>”、“ <”或“=”)0.25mol/L。
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
【题目】下列四个试管中,均发生反应Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是
试管 | 盐酸浓度(mol/L) | 温度(℃) | 锌的状态 |
A | 0.5 | 20 | 块状 |
B | 0.5 | 20 | 粉末状 |
C | 2 | 35 | 块状 |
D | 2 | 35 | 粉末状 |
A. AB. BC. CD. D



