题目内容
【题目】已知:A(g)+2B(g) ![]() 2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
2C(g) ΔH=-Q kJ·mol-1(Q>0),在恒容的密闭容器中充入1 mol A和2 mol B,一定条件下发生反应。下列有关说法正确的是( )
A. 平衡前,随着反应的进行,容器内气体密度逐渐减小
B. 平衡时,该反应放出的热量为Q kJ
C. 平衡后,再向容器中通入1 mol氦气,A的转化率增大
D. 平衡后,缩小容器容积,A的浓度增大
【答案】D
【解析】
A.密度=![]() ,m总和V在反应中始终不变,所以密度是定值,故A错误;
,m总和V在反应中始终不变,所以密度是定值,故A错误;
B.反应可逆,不可进行到底,因此,平衡时,该反应放出的热量小于Q kJ,故B错误;
C.平衡后,再向容器中通入1 mol氦气,容器容积固定,反应物和生成物浓度未变,速率未变,依然处于平衡状态,故C错误;
D.平衡后,缩小容器容积,体积缩小,反应物和生成物浓度均增大,根据勒夏特利原理,平衡虽然正向移动消耗A,但A的浓度还是比以前增大了,故D正确;
答案:D

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
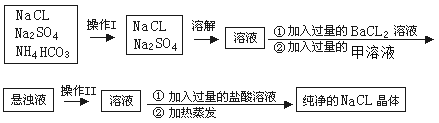
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
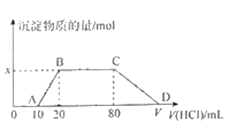
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)