题目内容
某课外活动小组在实验室用如图所示的装置进行实验,验证氨的某些性质并收集少量纯净氮气.试回答:
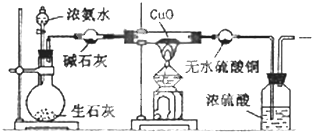
(1)实验前先将仪器按图连接好,然后 ,再开始实验.
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成 色,盛无水CuSO4的干燥管内出现 色,并在最后的出气导管处收集到纯净、干燥的N2.根据这些现象,硬质试管中的反应方程式为 ,这个反应说明氨气其有 性.
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是 .
(4)洗气瓶中浓硫酸的主要作用是 .
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是 (填编号)
A.排气法 B.排水法 C.用塑料袋或球胆收集.

(1)实验前先将仪器按图连接好,然后
(2)实验进行一段时间后,可以观察到硬质试管内黑色的CuO粉末变成
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是
(4)洗气瓶中浓硫酸的主要作用是
(5)在最后出气管口收集干燥、纯净的氮气,收集方法是
A.排气法 B.排水法 C.用塑料袋或球胆收集.
考点:氨的制取和性质
专题:氮族元素
分析:(1)装置是制备氨气,验证氨气的性质,所以装置必须气密性完好;
(2)氨气通过氧化铜加热反应生成红色铜、水和氮气,生成产物水能够使无水硫酸铜学生蓝色;依据元素化合价变化分析氨气中氮元素化合价升高失电子做还原剂;
(3)浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气;
(4)装置图分析可知,浓硫酸是吸收氮气中的水蒸气;
(5)氮气摩尔质量和空气相近,排水法会引入水蒸气,收集干燥、纯净的氮气可以用塑料袋或球胆收集.
(2)氨气通过氧化铜加热反应生成红色铜、水和氮气,生成产物水能够使无水硫酸铜学生蓝色;依据元素化合价变化分析氨气中氮元素化合价升高失电子做还原剂;
(3)浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气;
(4)装置图分析可知,浓硫酸是吸收氮气中的水蒸气;
(5)氮气摩尔质量和空气相近,排水法会引入水蒸气,收集干燥、纯净的氮气可以用塑料袋或球胆收集.
解答:
解:(1)装置是制备氨气,验证氨的某些性质并收集少量纯净氮气,实验前先将仪器按图连接好,然后检验装置气密性,再开始实验;
故答案为:检查气密性;
(2)根据实验目的是利用氨气与氧化铜反应制取氮气,则氧化铜为氧化剂,反应中氧化铜反应生成红色的铜,氨气被氧化成氮气,反应生成的水能够使白色的无水硫酸铜变成蓝色;即:氨气通过氧化铜加热反应生成红色铜、水和氮气,反应的化学方程式为:2NH3+3CuO
3Cu+3H2O+N2;
反应方程式中,氨气中N元素化合价从+3变为0价,化合价升高被氧化,在反应中还原剂,具有还原性,
故答案为:红;蓝;2NH3+3CuO
3Cu+3H2O+N2;还原;
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气;
故答案为:生石灰与水反应产生大量的热,有利于浓氨水分解挥发;
(4)浓硫酸可以吸收氮气中的水蒸气,干燥气体的作用,故答案为:干燥氮气;
(5)氮气摩尔质量为28g/mol,空气摩尔质量为29g/mol,二者相近,不能使用排空气法收集;排水法会引入水蒸气,所以收集干燥、纯净的氮气可以用塑料袋或球胆收集,故答案为:C.
故答案为:检查气密性;
(2)根据实验目的是利用氨气与氧化铜反应制取氮气,则氧化铜为氧化剂,反应中氧化铜反应生成红色的铜,氨气被氧化成氮气,反应生成的水能够使白色的无水硫酸铜变成蓝色;即:氨气通过氧化铜加热反应生成红色铜、水和氮气,反应的化学方程式为:2NH3+3CuO
| ||
反应方程式中,氨气中N元素化合价从+3变为0价,化合价升高被氧化,在反应中还原剂,具有还原性,
故答案为:红;蓝;2NH3+3CuO
| ||
(3)烧瓶内盛有生石灰,随着浓氨水的滴入,产生氨气,氨气产生的原因是浓氨水滴入生石灰,氧化钙和水反应放热,一水合氨分解生成氨气;
故答案为:生石灰与水反应产生大量的热,有利于浓氨水分解挥发;
(4)浓硫酸可以吸收氮气中的水蒸气,干燥气体的作用,故答案为:干燥氮气;
(5)氮气摩尔质量为28g/mol,空气摩尔质量为29g/mol,二者相近,不能使用排空气法收集;排水法会引入水蒸气,所以收集干燥、纯净的氮气可以用塑料袋或球胆收集,故答案为:C.
点评:本题考查了氨气的实验室制备及化学性质,题目难度中等,注意掌握常见气体的制备原理、反应装置及具有的化学性质,试题侧重基础知识的考查,有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
下列化学方程式或离子方程式正确的是( )
| A、乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O | ||
B、甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
| ||
C、实验室用液溴和苯在催化剂作用下制溴苯: | ||
D、将CO2通入苯酚钠溶液: |
用NA表示阿伏伽德罗常数,下列说法不正确的是( )
| A、2mol SO2和1mol O2在一定条件下反应,反应后分子总数大于2NA |
| B、25℃,在pH=2的1.0L H2SO4溶液中含有H+数目为0.01NA |
| C、在二氧化硅的晶体中,1mol SiO2含有Si-O键数目为NA |
| D、25mL 18mol?L-1浓硫酸与足量Zn反应,转移电子数为0.225NA |
下列说法正确的是( )
| A、物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等 |
| B、100 mL 1 mol?L-1的盐酸和50 mL 2 mol?L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等 |
| C、100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等 |
| D、100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等 |