题目内容
【题目】(1)某同学采用萃取—分液的方法从碘水中提取碘,主要操作步骤如下图:

①该同学所采用的萃取剂可能是______________(填序号)。
A 酒精 B 苯 C 四氯化碳 D 汽油
②甲、乙、丙3步实验操作中,不正确的是_______________(填“甲”、“乙”或“丙”)。
(2)实验室制取、净化并收集氯气涉及以下几个主要阶段:

现有以下2种试剂:A 饱和食盐水 B NaOH溶液
请在以上实际中选择填空(填“A”或“B”):
①X溶液应选用________________。
②尾气处理过程中,多余的氯气可用________________吸收。
【答案】C 丙 A B
【解析】
(1)①根据图示,该萃取剂的密度比水大;②分离时先分离下层液体;据此分析解答;
(2)由图可知,二氧化锰与浓盐酸反应生成氯气,生成的氯气中混有HCl,通过X除去HCl,然后通过浓硫酸干燥氯气,结合氯气的性质分析判断收集方法和尾气处理。
(1)①从碘水中提取碘,萃取剂不能与水混溶,根据图示,萃取后,下层有色,说明有机层在下层,有机溶剂的密度比水大,故答案为:C;
②振荡、静置分层操作均合理,而分离时应该先分离下层液体后倒出上层液体,则丙图不合理,故答案为:丙;
(2)由图可知,二氧化锰与浓盐酸反应生成氯气,生成的氯气中混有HCl,通过X除去HCl,然后通过浓硫酸干燥氯气,利用向上排空气收集,尾气利用NaOH溶液吸收。
①由上述分析可知,X为除去氯气中的氯化氢,应该选饱和食盐水,可抑制氯气的溶解,故答案为:A;
②氯气与NaOH反应生成无毒物质,则多余的氯气可用NaOH吸收,故答案为:B。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
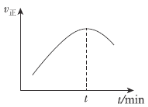
浙大优学小学年级衔接捷径浙江大学出版社系列答案【题目】探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+l0CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:
编号 | 温度 ℃ | 催化 剂(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪 色平均时间(min) | ||
体积(mL) | 浓度(mol/L) | 体积(mL) | 浓度(mol/L) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.a<12.7,b>6.7
B.可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
C.用H2C2O4表示该反应速率,v(实验1)约为6.6×l0-3 mol·L-1·min-1
D.用KMnO4表示该反应速率,v(实验3)>v(实验1)
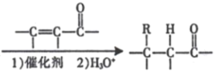
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为________。
(2)实验①反应后的溶液中由水电离出的c(OH-)=________mol·L-1;x________0.2mol·L-1(填“>”“<”或“=”)。
(3)下列关于实验②反应后的溶液说法不正确的是________(填字母)。
a.溶液中只存在着两个平衡
b.溶液中:c(A-)+c(HA)>0.1mol·L-1
c.溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(4)写出该电池工作时负极的电极反应式________。
(5)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为________。