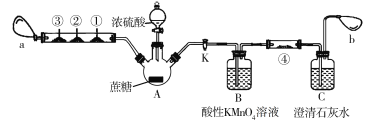
题目内容
【题目】现有三种可溶性物质A、B、C,其中A属于碱,B 、C属于盐,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | K+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)A的化学式为_____________。
(2)B溶液与C溶液反应可生成气体X,则X的化学式为_______,该反应的离子方程式为____________________________________。
(3)B、C溶液与A溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①C的化学式为_____________,检验溶液C中阴离子的实验方法是____________________。
②D溶于稀硝酸的离子方程式为________________________________。
③D与E的混合物a g,加入足量盐酸,完全反应生成的气体在标准状况下体积为V L,则求算E在混合物中的质量分数的表达式为________________________________________。
【答案】 Ba(OH)2 CO2 2H++CO32-=H2O+CO2↑ KHSO4 取少量C于一支洁净的试管中,先加盐酸,再加氯化钡,出现白色沉淀则说明有硫酸根 2H++BaCO3=Ba2++H2O+CO2↑ 
【解析】试题分析:可溶性物质A、B、C,A是碱,则A中含有OH-和Na+或Ba2+,A与B、C反应都生成白色沉淀,碳酸钡和硫酸钡都是沉淀,所以A是Ba(OH)2;B、C是盐,且都是可溶性盐,B溶液与C溶液反应可生成气体X,则应该是硫酸氢钠和碳酸钠,B、C溶液与A溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸,则D应该是BaCO3,则B是Na2CO3,C是NaHSO4,E是BaSO4,据此分析解答。
解析:(1)通过以上分析,A是氢氧化钡,其化学式为Ba(OH)2;
(2)B是碳酸钠、C是硫酸氢钠,二者反应生成二氧化碳,所以X是CO2,离子方程式为2H++CO32-=H2O+CO2↑;
(3)①通过以上分析知,C的化学式为NaHSO4,C中阴离子为硫酸根离子,其检验方法是先加稀盐酸除去Ag+、CO32-等离子干扰,然后再滴加氯化钡溶液,如果有白色沉淀生成,就说明含有硫酸根离子;
②D是碳酸钡,碳酸钡和稀硝酸反应生成硝酸钡、二氧化碳和水,离子方程式为2H++BaCO3=Ba2++H2O+CO2↑;
③D是碳酸钡、E是硫酸钡,碳酸钡和稀盐酸反应,而硫酸钡和稀盐酸不反应,n(CO2)= ![]() ,根据C原子守恒得n(CO2)=n(BaCO3)=
,根据C原子守恒得n(CO2)=n(BaCO3)= ![]() ,则m(BaCO3)=
,则m(BaCO3)= ![]() ×197g/mol=
×197g/mol= ![]() ,硫酸钡的质量=ag-
,硫酸钡的质量=ag- ![]() ,则硫酸钡在混合物中的质量分数的表达式为(ag-
,则硫酸钡在混合物中的质量分数的表达式为(ag- ![]() )÷ag×100%=
)÷ag×100%= 。
。

【题目】下列物质的分类正确的是( )
纯净物 | 碱性氧化物 | 酸性氧化物 | 强电解质 | |
① | 漂白粉 | SiO2 | CO2 | AlCl3溶液 |
② | CuSO45H2O | Na2O2 | N2O5 | NH4NO3 |
③ | 福尔马林 | CaO | Mn2O7 | HClO |
④ | 冰醋酸 | Na2O | SO2 | HCl |
A. ① B. ② C. ③ D. ④