题目内容
19. 若t1=25℃,则Kw1=10-14;若t2=100℃时,Kw2=10-12,则此时0.05mol•L-1的Ba (OH)2溶液的pH=11.
若t1=25℃,则Kw1=10-14;若t2=100℃时,Kw2=10-12,则此时0.05mol•L-1的Ba (OH)2溶液的pH=11.
分析 在25℃,则Kw=10-14,若t2=100℃时,Kw2=10-12,根据pH=-lgc(H+)计算0.05mol•L-1的Ba (OH)2溶液的pH.
解答 解:在25℃,则Kw1=10-14,
若t2=100℃时,Kw2=10-12,0.05mol•L-1的Ba (OH)2溶液中c(OH-)=0.05mol•L-1×2=0.1mol•L-1,
pH=-lgc(H+)=-lg$\frac{{10}^{-12}}{0.1}$=11,
故答案为:10-14;11.
点评 本题考查离子积常数、pH值得计算,注意离子积是一定温度下的常数,随温度改变,题目难度不大.

练习册系列答案
相关题目
9.下列条件下铁钉最容易生锈的是( )
| A. | 浸泡在煤油中 | B. | 浸泡在海水中 | ||
| C. | 置于空气中 | D. | 置于干燥的空气中 |
10.下列叙述正确的是( )
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物 的一氯取代物有四种 的一氯取代物有四种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 不能用裂化汽油萃取溴水中的溴. |
7.CH3-CH=CH-Cl,该有机物能发生( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀,⑦聚合反应.
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀,⑦聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
14.下列物质的类别与所含官能团都正确的是( )
| A. |  酚类-OH 酚类-OH | B. |  羧酸-COOH 羧酸-COOH | ||
| C. |  醛类-CHO 醛类-CHO | D. | CH3-O-CH3 酮类  |
4.常温下,0.1mol•L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是( )
| A. | HX、HY、HZ的酸性依次增强 | B. | 离子浓度:c(Z-)>c(Y-)>c(X-) | ||
| C. | 电离常数:K(HZ)<K(HY) | D. | c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) |
11. 图甲是在微生物的作用下将有机废水(主要含有葡萄糖)的化学能转化为电能的装置,图乙是用情性电极电解饱和食盐水制取一种家用消毒液的装置,下列说法错误的是( )
图甲是在微生物的作用下将有机废水(主要含有葡萄糖)的化学能转化为电能的装置,图乙是用情性电极电解饱和食盐水制取一种家用消毒液的装置,下列说法错误的是( )
 图甲是在微生物的作用下将有机废水(主要含有葡萄糖)的化学能转化为电能的装置,图乙是用情性电极电解饱和食盐水制取一种家用消毒液的装置,下列说法错误的是( )
图甲是在微生物的作用下将有机废水(主要含有葡萄糖)的化学能转化为电能的装置,图乙是用情性电极电解饱和食盐水制取一种家用消毒液的装置,下列说法错误的是( )| A. | M电极的电极反应式为:C6H12O6-24e-+6H2O═6CO2↑+24H+ | |
| B. | N电极上每消耗22.4L气体(标准状况)时,则有4molH+通过质子交换膜从负极区移向正极区 | |
| C. | 若装置乙所需的电能来自装置甲,则b极应与X极连接 | |
| D. | 由装置乙制得的家用消毒液的有效成分是NaClO |
8.在下列叙述的变化中,不属于化学变化的是( )
| A. | 天然气隔绝空气高温分解生成炭黑和氢气 | |
| B. | 石油分馏得到汽油、煤油和柴油 | |
| C. | 石油裂解得到乙烯、丙烯、丁二烯 | |
| D. | 煤干馏生成焦炭、煤焦油、焦炉气和粗氨水 |
9.已知碳碳单键可绕键轴自由旋转,某烃的结构简式如图所示,下列说法中正确的是( )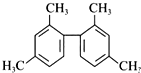

| A. | 该物质所有原子均可共面 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该有机物苯环上的一溴代物有6种 |