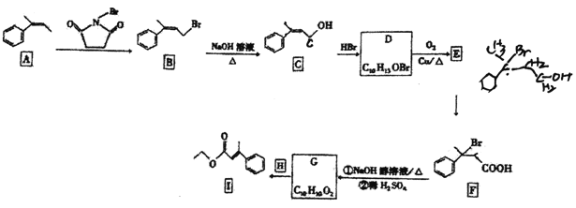
题目内容
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.足量MnO2和100mL6mol/L浓盐酸反应产生Cl2的分子数为0.15NA
B.100mL1molFeCl3溶液中所含Fe3+的数目为0.1NA
C.48g正丁烷和10g异丁烷的混合物中碳碳单键的数目为3NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
【答案】C
【解析】
A.100mL 6molL-1浓盐酸中含有氯化氢0.1L×6molL-1=0.6mol,MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,完全反应0.6mol氯化氢可以生成0.15mol氯气,由于稀盐酸不与二氧化锰反应,所以生成的氯气的物质的量小于0.15mol,产生的氯气分子数小于0.15NA,故A错误;
MnCl2+Cl2↑+2H2O,完全反应0.6mol氯化氢可以生成0.15mol氯气,由于稀盐酸不与二氧化锰反应,所以生成的氯气的物质的量小于0.15mol,产生的氯气分子数小于0.15NA,故A错误;
B.Fe3+为弱碱阳离子,水溶液中部分水解,故100 mL 1 molL-1FeCl3溶液中所含Fe3+数目小于0.1NA,故B错误;
C.正丁烷和异丁烷只是碳架不同,含有的碳碳单键均为3条,所以48g正丁烷和10g异丁烷,即混合物的物质的量为![]() =1mol,所以48g正丁烷和10g异丁烷的混合物中碳碳单键数目为3NA,故C正确;
=1mol,所以48g正丁烷和10g异丁烷的混合物中碳碳单键数目为3NA,故C正确;
D.SO2和O2的催化反应为可逆反应,反应不可能完全进行,所以密闭容器中,反应生成三氧化硫的物质的量小于2mol,则反应后气体总物质的量大于2mol,反应后分子总数大于2NA,故D错误;
故选C。

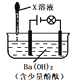
【题目】滴有酚酞的Ba(OH)2溶液显红色,在上述溶液中分别滴加X溶液后有下列现象。下列说法不正确的是
序号 | 装置 | X溶液 | 现象 |
I |
| 盐酸 | 溶液红色褪去,无沉淀,灯泡亮度没有明显变化 |
II | Na2SO4 | 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化 | |
III | H2SO4 | 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗 |
A. 实验I中溶液红色褪去,说明发生了反应H+ + OH- =H2O
B. 实验II中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在有大量的Na+与OH-
C. 实验III中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应Ba2+ + 2OH- + 2H+ + SO42- == BaSO4↓+ 2H2O
D. 将实验II中Na2SO4溶液换成CuSO4溶液,现象与原实验II中的现象相同