题目内容
X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子价电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)Y、Q的元素符号依次为
(2)Y与Z的第一电离能大小关系是(用元素符号回答)
(3)X、Y、Z两两组合可形成很多等电子体,请任意写出两组等电子体
(4)Q在元素周期表
 .
.
(5)X与W的电负性大小关系是(用元素符号回答)
 .
.
(1)Y、Q的元素符号依次为
N
N
、Cr
Cr
;(2)Y与Z的第一电离能大小关系是(用元素符号回答)
N>O
N>O
;(3)X、Y、Z两两组合可形成很多等电子体,请任意写出两组等电子体
CO2与N2O
CO2与N2O
、CO与CN-
CO与CN-
;(4)Q在元素周期表
d
d
区,其价电子排布图为

(5)X与W的电负性大小关系是(用元素符号回答)
S>C
S>C
,这两种元素组成的一种化合物是一种常见的溶剂,其电子式为

分析:X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为nsnnp2n,s能级最多容纳2个电子,故Z原子外围电子排布式为2s22p4,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s23p4,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素,以此解答该题.
解答:解:X、Y、Z、W、Q 五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为nsnnp2n,s能级最多容纳2个电子,故Z原子外围电子排布式为2s22p4,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s23p4,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素,
(1)由上述分析可知,Y为N元素,Q为Cr元素,故答案为:N;Cr;
(2)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量降低,第一电离能高于氧元素,故答案为:N>O;
(3)CO2与N2O,CO 与CN-,CO32-与 NO3-等为等电子体,故答案为:CO2与N2O;CO 与CN-等;
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,价电子排布图为 ,
,
故答案为:d; ;
;
(5)非金属性越强电负性越大,故电负性S>C,两元素形成的化合物是一种常见的溶剂为CS2,电子式为 ,
,
故答案为:S>C; .
.
(1)由上述分析可知,Y为N元素,Q为Cr元素,故答案为:N;Cr;
(2)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量降低,第一电离能高于氧元素,故答案为:N>O;
(3)CO2与N2O,CO 与CN-,CO32-与 NO3-等为等电子体,故答案为:CO2与N2O;CO 与CN-等;
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,价电子排布图为
 ,
,故答案为:d;
 ;
;(5)非金属性越强电负性越大,故电负性S>C,两元素形成的化合物是一种常见的溶剂为CS2,电子式为
 ,
,故答案为:S>C;
 .
.点评:本题考查结构与位置关系、核外电子排布规律、常用化学用语等,难度不大,注意基础知识的掌握.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
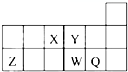 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图,下列说法正确的是( )| A、元素Y最高正化合价与最低负化合价的绝对值之和的数值等于8 | B、原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) | C、离子Y2-和Z3+半径的大小顺序为:r(Y2-)>r(Z3+) | D、元素W的最高价氧化物对应的水化物的酸性比Q的强 |
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的( ) (2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
(2012?天津模拟)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )