题目内容
工业合成氨与制备硝酸一般可连续生产,流程如图1所示:
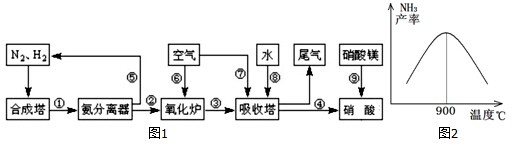
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K= (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1 573K(填“>”、“<”或“=”).
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是 .
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1则甲烷直接将NO2还原为N2的热化学方程式为: .
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为 .

(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2,T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
考点:化学平衡常数的含义,热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:(1)根据平衡常数表达式以及各种物质的浓度知识来回答;
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)根据盖斯定律来计算反应的焓变,进而书写热化学方程式;
(5)燃料电池中,燃料做负极.
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)根据盖斯定律来计算反应的焓变,进而书写热化学方程式;
(5)燃料电池中,燃料做负极.
解答:
解:(1)CO+H2O(g) CO2 +H2
CO2 +H2
初始:0.2 0.3 0 0
变化:0.12 0.12 0.12 0.12
平衡:0.08 0.18 0.12 0.12
则K=
=1,
故答案为:1;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<573K;
故答案为:<;
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)根据题意:①
CH4(g)+2NO2(g)=2NO(g)+
CO2(g)+H2O(g)△H=
×(-574kJ?mol-1)=-287kJ?mol-1;
CH4(g)+2NO(g)=N2(g)+
CO2(g)+H2O(g)△H=
×(-1160kJ?mol-1)=-580kJ?mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,
所以△H=-287kJ?mol-1-580kJ?mol-1=-867kJ?mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(5)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O.
故答案为:2NH3-6e-+6OH-→N2+6H2O.
 CO2 +H2
CO2 +H2初始:0.2 0.3 0 0
变化:0.12 0.12 0.12 0.12
平衡:0.08 0.18 0.12 0.12
则K=
| 0.12×0.12 |
| 0.08×0.18 |
故答案为:1;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<573K;
故答案为:<;
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)根据题意:①
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,
所以△H=-287kJ?mol-1-580kJ?mol-1=-867kJ?mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1;
(5)在燃料电池中,燃料做负极,则通入氨气的电极是负极,碱性条件下,该电极发生反应的电极反应式为2NH3-6e-+6OH-→N2+6H2O.
故答案为:2NH3-6e-+6OH-→N2+6H2O.
点评:本题是一道工业合成氨的综合性知识题目,题目难度较大,注意利用三段式法解答,特别是盖斯定律的运用以及燃料电池的电极反应的书写.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
甲烷和丙烷以等体积混合其体积为V L,完全燃烧时所需氧气的体积(同温同压)是( )
| A、1.25V L |
| B、2.25V L |
| C、2.5V L |
| D、3.5V L |
某有机物的结构简式为CH2=CHCOOCH3,它不可能具有的性质是( )
| A、能使酸性高锰酸钾溶液褪色 |
| B、能水解 |
| C、能使溴的四氧化碳溶液褪色 |
| D、能与Na2CO3溶液反应 |
MgCl2溶液与Na2SO4溶液混和后,c(Mg2+)=c(SO42-),则下列说法不正确的是( )
| A、混和液中c(Cl-)=c(Na+) |
| B、混和液中c(Cl-)=2c(SO42-) |
| C、混和前两溶液体积相等 |
| D、混和前两溶液中MgCl2与Na2SO4物质的量相等 |
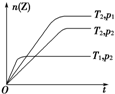 反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2 |
| B、T1<T2,p1>p2 |
| C、T1>T2,p1>p2 |
| D、T1>T2,p1<p2 |
下列是有关实验的叙述,正确的是( )
| A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| B、分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| C、加热氯化钠溶液得氯化钠固体,需用表面皿 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
某位同学在配制980mL 0.1mol/L Na2CO3溶液的实验过程时,对该实验的有关叙述正确的是( )
| A、计算需要Na2CO3.10 H2O的质量为28.0 g |
| B、用带游码的托盘天平称量时误用了“左码右物”方法,而导致所配溶液浓度偏低 |
| C、定容时,沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液的凹液面的最低处恰好与刻度线相切为止即可 |
| D、定容时,不慎加蒸馏水超过刻度线,在超量不多的情况下可以立即用胶头滴管将多余的水吸出 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: