题目内容
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如下图所示:
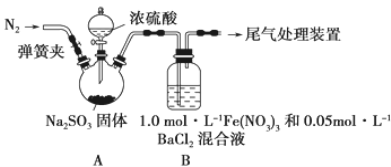
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1(即c(H+)=0.1 mol·L-1),回答下列问题:
(1)装置A中反应的化学方程式是_____________________________________________
(2)滴加浓硫酸之前应打开弹簧夹向装置中通入一段时间的N2,目的是________________________________
(3)装置B中产生了白色沉淀,其成分是___________,说明SO2具有___________性。
(4)分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+、酸性条件下NO3-都反应;
猜想2:___________________;
猜想3:在酸性条件下SO2与NO3—反应;
①按猜想2,装置B中反应的离子方程式是 _____________________________________;
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是________________(填字母)。
A.1.5 mol·L-1Fe(NO3)2溶液
B.0.1 mol·L-1硝酸钠溶液
C.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
D.3.0 mol·L-1 NaNO3和0.1 mol·L-1盐酸等体积混合的溶液
【答案】 Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O 排除空气对实验的干扰 BaSO4 还原 SO2与Fe3+反应 SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+ C
【解析】(1)装置A中是亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫和水,其反应的化学方程式是Na2SO3+H2SO4(浓)= Na2SO4+SO2↑+H2O;
(2)因为氧气能氧化Na2SO3,会对实验有影响,所以为排除空气对实验的干扰,滴加浓硫酸之前应先通入氮气,将空气排出。
(3)因为二氧化硫可与硝酸根离子发生氧化还原反应生成硫酸根离子,进而生成硫酸钡沉淀;所以装置B中产生了白色沉淀是硫酸钡沉淀;二氧化硫表现了还原性;
(4)综合猜想1、3可知猜想2:SO2与Fe3+反应;
①按猜想2,装置B中反应的离子方程式是;SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
②按猜想3:在酸性条件SO2与NO3-发生氧化还原反应,只要溶液中硝酸根离子浓度不变即可,,实验c(NO3-)=3mol/L,则可用6.0molL-1NaNO3和0.2molL-1盐酸等体积混合的溶液代替。

【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,这四种元素的原子最外层电子数之和是24,下列说法中正确的是( )
X | Y | |
Z | W |
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. 四种元素的单质中,W单质的熔、沸点最高
D. X的气态氢化物可与它的最高价氧化物的水化物发生反应




