题目内容
6.为了确定(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)的成分,下列实验操作及叙述中正确的是( )| A. | 取少量样品放入试管中,加热,试管口放一团蘸有无水硫酸铜粉末的棉花团,变蓝则可证明晶体的成分中一定含有结晶水 | |
| B. | 取少量样品溶于水,向溶液中滴入几滴新制氯水,再滴入2滴KSCN溶液,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 取少量样品溶于水,滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量样品放入试管中,加入少量浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,则可证明晶体的成分中是否含有NH4+ |
分析 A、加热失去结晶水;
B、向溶液中滴入几滴新制氯水,再滴入2滴KSCN溶液,溶液变为红色,只能说明滴入氯水后溶液中含Fe3+;
C、依据硫酸根离子的检验方法分析判断;
D、加入的浓NaOH溶液能和NH4+反应生成NH3.
解答 解:A、晶体加热后能使无水硫酸铜变蓝,说明有水生成,则证明晶体中含结晶水,故A正确;
B、向溶液中滴入几滴新制氯水,再滴入2滴KSCN溶液,溶液变为红色,说明含Fe3+,但此Fe3+不一定是由Fe2+氧化而来的,可能是原来含有的,故B错误;
C、加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-,这是硫酸根离子的检验方法,故C错误;
D、加入的浓NaOH溶液能和NH4+反应生成NH3,故向样品中加入少量浓NaOH溶液并加热,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明有氨气生成,则晶体的成分中含有NH4+,故D正确.
故选AD.
点评 本题考查考查化学实验方案的评价,涉及物质的鉴定,难度不大,能熟悉常见结晶水合物的颜色,溶液中各种水合离子的颜色,熟练掌握常见离子的检验方法与操作.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的.下列环境问题与过度排放的物质对应不正确的是 ( )
| A. | 雾霾--CO | B. | 白色污染--废弃塑料 | ||
| C. | 酸雨--SO2 | D. | 温室效应--CO2 |
1.下列关于CO的叙述不正确的是( )
| A. | CO的摩尔质量28g/mol | |
| B. | 1molCO中所含分子数为6.02×1023个 | |
| C. | 1mol CO的质量是28g | |
| D. | 常温常压下,1mol CO的体积为22.4 L |
11.新版人民币的发行,引发了人们对有关人民币中化学知识的关注.下列表述不正确的是( )
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 用于人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质 | |
| C. | 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖 |
18.下列物质不能使品红溶液褪色的是( )
| A. | 氯气 | B. | 过氧化钠 | C. | 次氯酸钠 | D. | 氢氧化钠 |
15.合金在生产及科研中具有广泛的应用.下列物质属于合金的是( )
| A. | 生铁 | B. | 石墨 | C. | 硅晶体 | D. | 水银 |
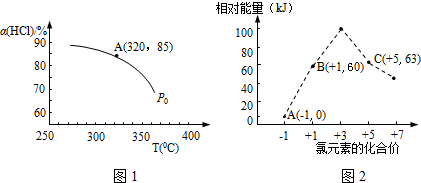
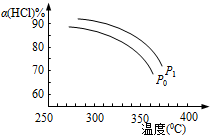 ,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.