题目内容
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:NH3+CO2+H2O+NaCl(饱和)=NaHCO3(晶体)↓+NH4Cl
某兴趣小组欲测定上述反应所制得的样品中碳酸氢钠的纯度,设计了如下两种方案:
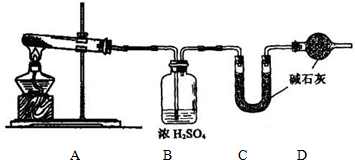
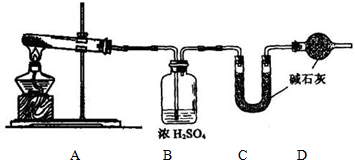
(1)方案一:取wg样品按如图装置(气密性完好)进行实验.
①装置B的作用是______
②装置D的作用是______
③实验中需要称量的装置是______(填写字母)
(2)方案二:取wg样品溶于水后,进行下图所示实验:

①试剂X是______;
②步骤②加入CaCl2溶液后的主要操作包括______、洗涤、______、称量
③样品中碳酸氢钠的纯度为______(用含w、m的代数式表示).
(3)上述方案一测定的结果偏小,可能的原因是______.
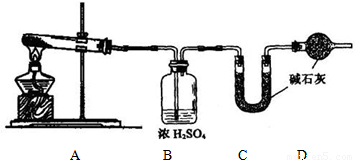
【答案】分析:(1)由图可知,该实验方案为:加热分解碳酸氢钠样品,通过C装置增重测定是二氧化碳的质量,进而计算碳酸氢钠的质量,计算其质量分数,故加入C装置的气体应干燥,装置B应是吸收水蒸气,由于碱石灰可以吸收空气中的二氧化碳与水蒸气,D装置目的防止空气中的二氧化碳和水蒸汽进入C中影响二氧化碳质量的测定;
(2)由方案图可知,该实验方案为:将碳酸氢钠转化为碳酸盐,碳酸盐与氯化钙反应生成碳酸钙沉淀,过量、洗涤、干燥称量碳酸钙沉淀质量,根据碳酸钙的质量计算碳酸氢钠的质量,进而计算质量分数,故试剂X为氢氧化钠溶液;
(3)方案一中装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收.
解答:解:(1)由图可知,该实验方案为:加热分解碳酸氢钠样品,通过C装置增重测定是二氧化碳的质量,进而计算碳酸氢钠的质量,计算其质量分数,故加入C装置的气体应干燥,装置B应是吸收水蒸气,由于碱石灰可以吸收空气中的二氧化碳与水蒸气,D装置目的防止空气中的二氧化碳和水蒸汽进入C中影响二氧化碳质量的测定,
①由上述分析的实验原理可知,装置B的作用是:吸收水蒸汽,
故答案为:吸收水蒸汽;
②由上述分析的实验原理可知,装置D的作用是:防止空气中的二氧化碳和水蒸汽进入C中,
故答案为:防止空气中的二氧化碳和水蒸汽进入C中;
③由上述分析的实验原理可知,通过C装置增重测定是二氧化碳的质量,实验中需要称量的装置是C,
故答案为:C;
(2)由方案图可知,该实验方案为:将碳酸氢钠转化为碳酸盐,碳酸盐与氯化钙反应生成碳酸钙沉淀,过量、洗涤、干燥称量碳酸钙沉淀质量,根据碳酸钙的质量计算碳酸氢钠的质量,进而计算质量分数,
①试剂X将碳酸氢钠转化为碳酸盐,故试剂X为氢氧化钠溶液,
故答案为:NaOH溶液;
②步骤②加入CaCl2溶液后生成碳酸钙沉淀,并把沉淀与溶液分离获得碳酸钙沉淀,得到碳酸钙的具体质量,故主要操作包括过滤、洗涤、干燥、称量,
故答案为:过滤、干燥;
③得到碳酸钙的质量为mg,根据碳元素守恒可知,碳酸氢钠的物质的量= =0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为
=0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为 ×100%=
×100%= ×100%,
×100%,
故答案为: ×100%;
×100%;
(3)方案一中装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收,导致测定二氧化碳的质量偏小,计算测定的碳酸氢钠的质量分数偏小,
故答案为:装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收.
点评:本题考查化学实验,涉及对实验方案的理解、对装置的分析评价、物质的分离提纯、数据处理与误差分析等,难度中等,是对知识的综合利用,较好的考查学生的综合能力,理解实验方案是关键.
(2)由方案图可知,该实验方案为:将碳酸氢钠转化为碳酸盐,碳酸盐与氯化钙反应生成碳酸钙沉淀,过量、洗涤、干燥称量碳酸钙沉淀质量,根据碳酸钙的质量计算碳酸氢钠的质量,进而计算质量分数,故试剂X为氢氧化钠溶液;
(3)方案一中装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收.
解答:解:(1)由图可知,该实验方案为:加热分解碳酸氢钠样品,通过C装置增重测定是二氧化碳的质量,进而计算碳酸氢钠的质量,计算其质量分数,故加入C装置的气体应干燥,装置B应是吸收水蒸气,由于碱石灰可以吸收空气中的二氧化碳与水蒸气,D装置目的防止空气中的二氧化碳和水蒸汽进入C中影响二氧化碳质量的测定,
①由上述分析的实验原理可知,装置B的作用是:吸收水蒸汽,
故答案为:吸收水蒸汽;
②由上述分析的实验原理可知,装置D的作用是:防止空气中的二氧化碳和水蒸汽进入C中,
故答案为:防止空气中的二氧化碳和水蒸汽进入C中;
③由上述分析的实验原理可知,通过C装置增重测定是二氧化碳的质量,实验中需要称量的装置是C,
故答案为:C;
(2)由方案图可知,该实验方案为:将碳酸氢钠转化为碳酸盐,碳酸盐与氯化钙反应生成碳酸钙沉淀,过量、洗涤、干燥称量碳酸钙沉淀质量,根据碳酸钙的质量计算碳酸氢钠的质量,进而计算质量分数,
①试剂X将碳酸氢钠转化为碳酸盐,故试剂X为氢氧化钠溶液,
故答案为:NaOH溶液;
②步骤②加入CaCl2溶液后生成碳酸钙沉淀,并把沉淀与溶液分离获得碳酸钙沉淀,得到碳酸钙的具体质量,故主要操作包括过滤、洗涤、干燥、称量,
故答案为:过滤、干燥;
③得到碳酸钙的质量为mg,根据碳元素守恒可知,碳酸氢钠的物质的量=
 =0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为
=0.01m mol,故样品中碳酸氢钠质量为0.01m mol×84g/mol=0.84m g,故碳酸氢钠的纯度为 ×100%=
×100%= ×100%,
×100%,故答案为:
 ×100%;
×100%;(3)方案一中装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收,导致测定二氧化碳的质量偏小,计算测定的碳酸氢钠的质量分数偏小,
故答案为:装置中会残留CO2气体,生成的CO2气体不能完全被装置C中的碱石灰吸收.
点评:本题考查化学实验,涉及对实验方案的理解、对装置的分析评价、物质的分离提纯、数据处理与误差分析等,难度中等,是对知识的综合利用,较好的考查学生的综合能力,理解实验方案是关键.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示: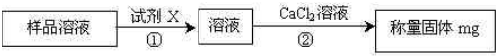
 Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
 工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:
工业上用侯氏制碱法可制得碳酸氢钠晶体,该反应原理可以用以下化学方程式表示:


