题目内容
下列物质只含有离子键的是( )
| A、CO2 |
| B、NaOH |
| C、MgCl2 |
| D、H2O |
考点:离子化合物的结构特征与性质
专题:
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,铵根离子和酸根离子之间存在离子键.
解答:
解:A.二氧化碳分子中C-O原子之间存在共价键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C正确;
D.水分子中H-O原子之间只存在共价键,故D错误;
故选C.
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B错误;
C.氯化镁中镁离子和氯离子之间只存在离子键,故C正确;
D.水分子中H-O原子之间只存在共价键,故D错误;
故选C.
点评:本题考查离子键和共价键的判断,侧重考查基本概念,明确物质的构成微粒即可解答,注意化学键和化合物之间的关系,题目难度不大.

练习册系列答案
相关题目
已知1-18号元素的离子aW3+、bX+、CY2-、dZ-都具有相同的电子层结构,则下列叙述正确的是( )
| A、四种元素位于同一周期 |
| B、氢化物的稳定性H2Y>HZ |
| C、离子的氧化性aW3+>bX+ |
| D、原子半径:X>Y>Z>W |
下列物质中既有极性键又有非极性键的非极性分子是( )
| A、CS2 |
| B、CH4 |
| C、CH3Cl |
| D、CH≡CH |
X、Y、Z代表三种元素的原子,X、Y有相同的电子层,Y、Z最外层电子数相同,已知三种元素的原子最外层电子数之和为17,三种元素的质子数之和为31.则X、Y、Z可能是( )
| A、N、O、S |
| B、Cl、N、P |
| C、Be、F、Cl |
| D、F、N、P |
下列离子方程式正确的是( )
| A、钾跟水反应:K+2H2O=K++2OH-+H2↑ |
| B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| C、硫酸氢钠溶液与NaOH溶液混合:HSO4-+OH-=H2O+SO42- |
| D、氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ |
下列各项表述与示意图一致,且文字图示均正确的是( )
A、 表示第三周期元素原子半径的变化规律 表示第三周期元素原子半径的变化规律 |
B、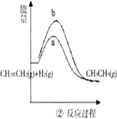 a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H>0在使用和未使用催化剂时,反应过程中的能量变化 |
C、 实验用于测定稀盐酸的浓度 |
D、 实验可用于验证HCl在水中的溶解性 |
 若将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
若将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.