题目内容
某学校研究性学习小组的三位同学,欲用浓硝酸来测定其铜银合金中铜的质量分数。已知:在反应过程中,随着浓硝酸浓度的降低,还原产物中还会有NO生成。请针对这三位同学的设计,完成下列问题:
(1)甲同学取合金样品14.0 g加入A中,然后将装置A、B相连,并向A中加入13.0 mol·L-1的硝酸25.0 mL充分反应后测得生成气体的体积为2.24 L(标准状况下),及反应后容器A中溶液H+浓度为1.0 mol·L-1(假设反应后溶液体积不变)。利用以上数据,你认为甲同学能得到合金中铜的质量分数吗?如果能,请写出计算过程及结果;如果不能,请简述理由。
(2)乙同学将装置A、C相连,向A中加入w g合金样品和足量浓硝酸充分反应,将生成的气体简单作了吸收处理后,便向反应后的A溶液中加入一种常见试剂,充分反应后,再经过简单的实验操作就达到了目的。请你简述他的实验思路。
(3)丙同学将装置A、D相连,向A中加入一定质量的合金样品和足量浓硝酸,充分反应后用排水集气法测定了生成气体的体积,也达到了实验目的。
①D中发生反应的化学方程式:______________________________________________。
②假设已知合金中Cu、Ag的总物质的量为a mol,水洗后气体的体积是b L(标准状况下),则合金中Cu的物质的量是___________。(结果不必简化)
(1)能。设Cu、Ag的物质的量分别为x、y,则有:

(氮守恒)
x=0.05 mol 即3.2 g
∴Cu的质量分数为:22.9%。
(2)向反应后的混合液中加入过量的NaCl溶液,过滤、洗涤并干燥、称量所得AgCl沉淀的质量,再进行计算求得合金中Ag的质量,再根据合金总质量,可得合金中Cu的质量分数。
(3)①3NO2+H2O====2HNO3+NO
②(![]() -a)mol
-a)mol
设Cu、Ag的物质的量分别为x,y
则有 (得失电子守恒)
(得失电子守恒)
∴x=(![]() -a)mol
-a)mol

练习册系列答案
相关题目
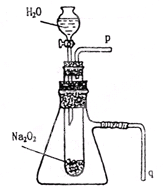 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来. Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下:
Ⅰ.某学校研究性学习小组开展“不同条件对化学反应速率影响的探究”课题,选用4mL 0.01mol?L-1KMnO4溶液与2mL 0.1mol?L-1 H2C2O4溶液进行实验,改变条件如下: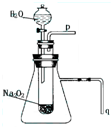 有演示实验:用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
有演示实验:用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.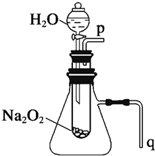 用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.