题目内容
某无色溶液中可能含有①Na+ ②Ba2+ ③Cl— ④Br— ⑤SO32— ⑥SO42—中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤序号 | 操 作 步 骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加入CCl4、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
- A.不能确定的离子是①
- B.不能确定的离子是③⑥
- C.肯定没有的离子是②⑤
- D.肯定含有的离子是④⑤
B
试题分析:溶液pH>7说明溶液中一定有亚硫酸根离子,一定无钡离子;加入氯水再加四氯化碳,下层呈橙色说明有溴离子Cl2+SO32-+H2O=SO42-+2Cl-+2H+、Cl2+2Br-=Br2+2Cl-(还原性SO32->Br-);向(2)所得水溶液中加入硝酸钡和稀硝酸有白色沉淀产生不能说明原溶液中有硫酸根离子,因第(2)步加氯水时,氯水已经将亚硫酸根离子氧化成硫酸根离子;滤液中加硝酸银溶液产生白色沉淀也不能说明原溶液中有氯离子,因第(2)步氯水氧化亚硫酸根离子时同时生成了氯离子。综上可知原溶液中一定有亚硫酸根离子和溴离子,一定没有钡离子,由溶液呈电中性可知溶液中一定有钠离子,可能有氯离子和硫酸根离子。
考点:离子共存
点评:亚硫酸根离子还原性大于溴离子,加氯水时先氧化亚硫酸根离子;溶液呈电中性,不可能只有阴离子而无阳离子,所以一定有Na+。
试题分析:溶液pH>7说明溶液中一定有亚硫酸根离子,一定无钡离子;加入氯水再加四氯化碳,下层呈橙色说明有溴离子Cl2+SO32-+H2O=SO42-+2Cl-+2H+、Cl2+2Br-=Br2+2Cl-(还原性SO32->Br-);向(2)所得水溶液中加入硝酸钡和稀硝酸有白色沉淀产生不能说明原溶液中有硫酸根离子,因第(2)步加氯水时,氯水已经将亚硫酸根离子氧化成硫酸根离子;滤液中加硝酸银溶液产生白色沉淀也不能说明原溶液中有氯离子,因第(2)步氯水氧化亚硫酸根离子时同时生成了氯离子。综上可知原溶液中一定有亚硫酸根离子和溴离子,一定没有钡离子,由溶液呈电中性可知溶液中一定有钠离子,可能有氯离子和硫酸根离子。
考点:离子共存
点评:亚硫酸根离子还原性大于溴离子,加氯水时先氧化亚硫酸根离子;溶液呈电中性,不可能只有阴离子而无阳离子,所以一定有Na+。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(2011?河西区一模)某无色溶液中可能含有 ①Na+、②Ba2+、③Cl-、④Br-、⑤SO42-、⑥SO32-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
|
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32-④可能含有I-.
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32-④可能含有I-.
| A、①③ | B、①②③ | C、③④ | D、②③④ |
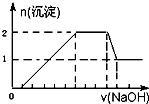 某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )
某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子中的几种,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示.下列说法一定正确的是( )| A、一定存在H+、Mg2+、Al3+、NH4+,一定不存在Na+、SO42-、Fe3+ | B、一定存在H+、Al3+、NH4+、SO42-,可能存在Na+、Mg2+ | C、溶液中c(H+):c(Al3+):c(Mg2+)为1:1:1 | D、溶液中c(H+):c(SO42-)为2:9 |