题目内容
(2010?南京二模)(1)在一定条件下,将1mol N2与3mol H2混合于一个10L密闭容器中,反应在不同温度下达到平稳时NH3的浓度如图1所示.其中,温度为T1时平稳混合气体中氨的体积分数为25%.
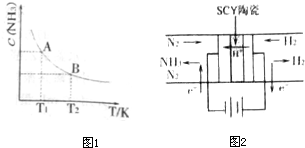
①当温度由T1变化到T2时,平稳常数KA
②T1温度达到平衡时N2的转化率为
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)此反应的△S
(已知:N2(g)+3H2(g)?2NH3(g)△=-92.44kJ/mol2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为

①当温度由T1变化到T2时,平稳常数KA
>
>
KB(填“>”、“<”或“=”)②T1温度达到平衡时N2的转化率为
40%
40%
.(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)?4NH3(g)+3O2(g)此反应的△S
>
>
0(填“>”、“<”或“=”)△H+1530kJ/mol
+1530kJ/mol
.(已知:N2(g)+3H2(g)?2NH3(g)△=-92.44kJ/mol2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol)
(3)科学家采用高质子导电性的SCY陶瓷(可传递H+),实现了低温常压下高转化率的电化学合成氨,其实验原理如图2所示,则阴极的电极反应式为
N2+6e-+6H+=2NH3
N2+6e-+6H+=2NH3
.分析:(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
②令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再根据转化率定义计算;
(2)正反应气体的物质的量增大,混乱度增大;
根据盖斯定律,由已知热化学方程式构造目标热化学方程式,据此计算;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.
②令参加反应的氮气的物质的量为nmol,利用三段式用n表示处于平衡时各组分的物质的量,根据氨气的体积分数列方程计算n的值,再根据转化率定义计算;
(2)正反应气体的物质的量增大,混乱度增大;
根据盖斯定律,由已知热化学方程式构造目标热化学方程式,据此计算;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气.
解答:解:(1)①由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数KA>KB,
故答案为:>;
②令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以
×100%=25%,解得n=0.4,
所以氮气的转化率为
×100%=40%,
故答案为:40%;
(2)正反应气体的物质的量增大,混乱度增大,故△S>0;
已知:①、N2(g)+3H2(g)?2NH3(g)△=-92.4kJ/mol
②、2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol
根据盖斯定律,①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),故△H=(-92.4kJ/mol)×2-3(-571.6kJ/mol)=+1530kJ/mol
故答案为:>;+1530kJ/mol;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
故答案为:>;
②令参加反应的氮气的物质的量为nmol,则:
N2(g)+3H2(g)
 2NH3(g)
2NH3(g)开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以
| 2n |
| (1-n)mol+(3-3n)mol+2nmol |
所以氮气的转化率为
| 0.4mol |
| 1mol |
故答案为:40%;
(2)正反应气体的物质的量增大,混乱度增大,故△S>0;
已知:①、N2(g)+3H2(g)?2NH3(g)△=-92.4kJ/mol
②、2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ/mol
根据盖斯定律,①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),故△H=(-92.4kJ/mol)×2-3(-571.6kJ/mol)=+1530kJ/mol
故答案为:>;+1530kJ/mol;
(3)阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e-+6H+=2NH3,
故答案为:N2+6e-+6H+=2NH3.
点评:本题考查化学平衡计算、反应热计算、原电池等,难度中等,旨在考查学生对知识的掌握与运用,加强基础知识的掌握理解.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目