题目内容
白磷放入热的CuS04溶液中发生如下反应:P+CuS04CuS04+H20→Cu3P+H3P04+H2S04,则160g CuS04所氧化的磷的质量为
- A.4.81 g
- B.5.60 g
- C.6.20 g
- D.8.14 g
C
分析:反应中P+CuS04+H20→Cu3P+H3P04+H2S04中,Cu元素化合价由+2价降低为+1,P元素化合价既升高又降低,P元素化合价由0价升高为+5、由0价降低为-3,故氧化剂为CuS04、P,还原剂为P,根据n= 计算160gCuS04的物质的量,根据电子转移守恒计算160gCuS04所氧化的磷的物质的量,再根据m=nM计算CuS04所氧化的磷的质量.
计算160gCuS04的物质的量,根据电子转移守恒计算160gCuS04所氧化的磷的物质的量,再根据m=nM计算CuS04所氧化的磷的质量.
解答:反应中P+CuS04+H20→Cu3P+H3P04+H2S04中,Cu元素化合价由+2价降低为+1,P元素化合价既升高又降低,P元素化合价由0价升高为+5、由0价降低为-3,故氧化剂为CuS04、P,还原剂为P,
160gCuS04的物质的量为 =1mol,根据电子转移守恒可知,160gCuS04所氧化的磷的物质的量为
=1mol,根据电子转移守恒可知,160gCuS04所氧化的磷的物质的量为 =0.2mol,故CuS04所氧化的磷的质量为0.2mol×31g/mol=6.2g,
=0.2mol,故CuS04所氧化的磷的质量为0.2mol×31g/mol=6.2g,
故选C.
点评:本题考查氧化还原反应的有关计算,难度中等,注意根据电子转移守恒解答,注意反应中各元素化合价变化.
分析:反应中P+CuS04+H20→Cu3P+H3P04+H2S04中,Cu元素化合价由+2价降低为+1,P元素化合价既升高又降低,P元素化合价由0价升高为+5、由0价降低为-3,故氧化剂为CuS04、P,还原剂为P,根据n=
 计算160gCuS04的物质的量,根据电子转移守恒计算160gCuS04所氧化的磷的物质的量,再根据m=nM计算CuS04所氧化的磷的质量.
计算160gCuS04的物质的量,根据电子转移守恒计算160gCuS04所氧化的磷的物质的量,再根据m=nM计算CuS04所氧化的磷的质量.解答:反应中P+CuS04+H20→Cu3P+H3P04+H2S04中,Cu元素化合价由+2价降低为+1,P元素化合价既升高又降低,P元素化合价由0价升高为+5、由0价降低为-3,故氧化剂为CuS04、P,还原剂为P,
160gCuS04的物质的量为
 =1mol,根据电子转移守恒可知,160gCuS04所氧化的磷的物质的量为
=1mol,根据电子转移守恒可知,160gCuS04所氧化的磷的物质的量为 =0.2mol,故CuS04所氧化的磷的质量为0.2mol×31g/mol=6.2g,
=0.2mol,故CuS04所氧化的磷的质量为0.2mol×31g/mol=6.2g,故选C.
点评:本题考查氧化还原反应的有关计算,难度中等,注意根据电子转移守恒解答,注意反应中各元素化合价变化.

练习册系列答案
相关题目
Fe2O3、Cu2O都是红色粉末,常用作颜料.某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物.探究过程如下:
(1)查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.溶于稀硝酸会生成NO写出Cu2O 溶于稀硝酸的化学反应方程式:______
(2)提出假设:假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O假设3:______
设计探究实验:
限选试剂:稀硫酸、稀硝酸、KSCN 溶液、NaOH溶液、高锰酸钾溶液、新制氯水、Fe屑
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量粉末于试管中,加入足量的稀硝酸,振荡,溶解,分为A、B两支试管,在A试管中滴加1~2滴 KSCN 溶液,观察. | |
| 2 | ||
| … |
 +H2O
+H2O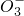
 +Al3++2S
+Al3++2S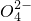 +2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O
+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O