��Ŀ����
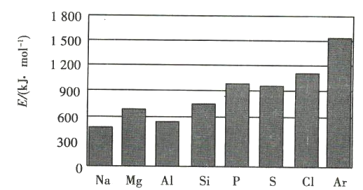
����Ŀ��ǰ������Ԫ��X��Y��Z��W��Q��ԭ��������������X��Yͬ���������ڣ�Y�Ļ�̬ԭ�ӵ�s��������p��������ȣ�Z�ǵؿ��к������Ľ���Ԫ�أ�W��ԭ�Ӻ���۵����Ų�ʽΪ![]() ��Q�Ļ�̬ԭ�ӵ�δ�ɶԵ�������ͬ����Ԫ�������ġ�����˵��������ǣ� ��
��Q�Ļ�̬ԭ�ӵ�δ�ɶԵ�������ͬ����Ԫ�������ġ�����˵��������ǣ� ��
A.����̬�⻯����ȶ��ԣ�Y>X
B.�����ӵİ뾶��Z>X>Y
C.Z������������Ӧ��ˮ���������ǿ�ᷴӦ��������ǿ�Ӧ
D.��Y��W��Q����Ԫ���γɵ�ij�ֻ���������ڼ��˾���Ƿ�ƺ�ݳ�
���𰸡�B
��������
Z�ǵؿ��к������Ľ���Ԫ�أ�˵��ZΪAl��W��ԭ�Ӻ���۵����Ų�ʽΪ![]() ��˵��WΪK��Y�Ļ�̬ԭ�ӵ�s��������p��������ȣ���֪YΪO��X��Yͬ���������ڣ����ǰ������Ԫ��X��Y��Z��W��Q��ԭ��������������XΪN��Q�Ļ�̬ԭ�ӵ�δ�ɶԵ�������ͬ����Ԫ�������ģ���֪QΪCr��
��˵��WΪK��Y�Ļ�̬ԭ�ӵ�s��������p��������ȣ���֪YΪO��X��Yͬ���������ڣ����ǰ������Ԫ��X��Y��Z��W��Q��ԭ��������������XΪN��Q�Ļ�̬ԭ�ӵ�δ�ɶԵ�������ͬ����Ԫ�������ģ���֪QΪCr��
A.Ԫ�صķǽ�����Խǿ�������̬�⻯��Խ�ȶ������ڷǽ����ԣ�O>N������̬�⻯����ȶ��ԣ�Y>X��A����ȷ��
B.������ͬ��������Ų������ӣ�ԭ������ԽС��������Ӱ뾶Խ�������ӵİ뾶��X>Y>Z�� B�����
C. Al��OH��3������ǿ�ᷴӦ��������ǿ�Ӧ��C����ȷ��
D.�ظ���ؾ���ǿ�����ԣ��ܹ������ƾ�����������ɫ�����˱仯�������ڼ��˾���Ƿ�ƺ�ݳ���D����ȷ��
��ѡB��

 ��������ϵ�д�
��������ϵ�д�����Ŀ��![]() ��
��![]() ��
��![]() ��
��![]() ��Ԫ�����ڱ�ǰ�������е����ֳ���Ԫ�أ��������Ϣ���±���
��Ԫ�����ڱ�ǰ�������е����ֳ���Ԫ�أ��������Ϣ���±���
Ԫ�ش��� | �����Ϣ |
|
|
| ���³�ѹ�£� |
|
|
|
|
��1��![]() λ��Ԫ�����ڱ���__________���ڵ�__________�塣
λ��Ԫ�����ڱ���__________���ڵ�__________�塣
��2��![]() ��һ�ֳ��õ��ܼ���
��һ�ֳ��õ��ܼ���![]() �ķ����д��ڸ�
�ķ����д��ڸ�![]() ������
������![]() ��
��![]() ���ֹ��ۼ��У����ļ��Խ�ǿ����_____________�������ϳ�����___________��
���ֹ��ۼ��У����ļ��Խ�ǿ����_____________�������ϳ�����___________��
��3��д��![]() Ԫ�ص�ԭ�Ӻ�������Ų�ʽ��__________��
Ԫ�ص�ԭ�Ӻ�������Ų�ʽ��__________��
����Ŀ��������һ�������Դ����ұ�𡢵��������ϵ�����Ӧ�ù㷺����ش��������⣺
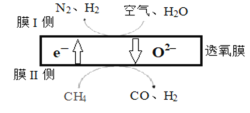
��1��ij�����Ŷ�������Ĥ���N2��H2�Ĺ���ԭ����ͼ��ʾ(������N2��O2�����ʵ���֮��Ϊ4��1�������������У�ĤI��������������ʵ���֮��Ϊn(H2):n(N2)=3:1�����������õ�����Ϊ_______________��Ĥ������ĵ缫��ӦʽΪ_________________
��2����CO��H2�ϳɼ״����Ȼ�ѧ����ʽΪCO(g)+2H2(g) CH3OH(g) ��H1
��֪CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H2=-49.0kJ/mol
CO(g)+H2O(g) CO2(g)+H2(g) ��H3=-41.1kJ/mol
���H1=________________
��3��������ɱ���ܱ������г���1molCO��2.2molH2���ں��º�ѹ�����·�����Ӧ��CO(g)+2H2(g) CH3OH(g)��ƽ��ʱ��CO��ת������(CO)���¶ȡ�ѹǿ�ı仯�����ͼ1��ʾ��
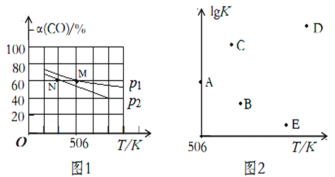
��ѹǿp1_____(������������������������)p2��M��ʱ���÷�Ӧ��ƽ�ⳣ��Kp��______(��ƽ���ѹ��ʾ����ѹ=��ѹ�����ʵ�������)
�ڲ�ͬ�¶��£��÷�Ӧ��ƽ�ⳣ���Ķ���ֵlgK��ͼ2������A��Ϊ506Kʱƽ�ⳣ���Ķ���ֵ����B��C��D��E�ĵ�������ȷ��ʾ�÷�Ӧ��lgK���¶�(T)�Ĺ�ϵ����_____________
��4��H2��ԭNO�ķ�ӦΪ2NO(g)+2H2(g)N2(g)+2H2O(l)��ʵ���÷�Ӧ���ʵı���ʽΪv=k��cm��NO����cn��H2����k�����ʳ�����ֻ���¶��йأ���
��ij�¶��£���Ӧ�����뷴Ӧ��Ũ�ȵı仯��ϵ���±���ʾ��
��� | c��H2��/��mol��L-1�� | c��NO��/��mol��L-1�� | v/��mol��L-1��min-1�� |
1 | 0.10 | 0.10 | 0.414 |
2 | 0.10 | 0.20 | 1.656 |
3 | 0.50 | 0.10 | 2.070 |
�ɱ������ݿ�֪��m=_______��n=_______��
��������Ӧ���������У���2NO(g)+2H2(g) N2(g)+H2O2(l)(����Ӧ)
��H2O2(l)+H2(g) 2H2O(l)(�췴Ӧ)������˵����ȷ����_______
A. H2O2�Ǹ÷�Ӧ�Ĵ��� B. �ܷ�Ӧ�����ɷ�Ӧ�������ʾ���
C. ��Ӧ���Ļ�ܽϸ� D.��Ӧ����NO��H2����ײ��������Ч
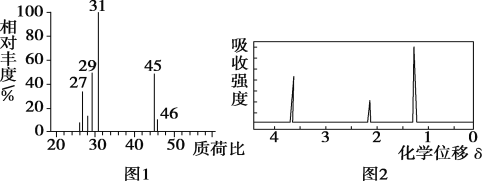
����Ŀ���л���AΪ��Ȼ������ˮ��������C��H��N��O����Ԫ�ء�ij�о�С��Ϊ�о�A�������ṹ������������ʵ�飺
ʵ�鲽�� | ʵ����� |
(1)��A����ʹ�������������ܶ�ԼΪ��ͬ�����¿����ܶȵ�4.6���� | A����Է�������Ϊ_____ |
(2)��26.6gA��������O2�г��ȼ�գ���ʹ��������λ���ͨ��Ũ���ᡢ��ʯ�ҡ����ȵ�ͭ��(����ÿ�����屻��ȫ����)��ǰ���߷ֱ�����12.6g��35.2g��ͨ��ͭ�����ռ���������Ϊ2.24L(��״����)�� | A�ķ���ʽΪ_______ |
(3)��ȡ13.3gA����������NaHCO3��ĩ��ȫ��Ӧ����������4.48L(��״����)�� | A�к��еĹ���������Ϊ____ |
(4)A�ĺ˴Ź���������ʾ������ҷ������Ϊ1:1:1:2:2�� | A�Ľṹ��ʽΪ_______ |
(5)������A��Ӧ����һ����Ԫ��״������Ļ�ѧ����ʽΪ_________ | |