题目内容
1.铁、氮的化合物在生产、生活中有着广泛的应用,请回答下列有关问题:Ⅰ、三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)写出该反应的化学方程式3NF3+5H2O=2NO+HNO3+9HF,反应中生成0.2mol HNO3,转移的电子数目为0.4NA.
(2)三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F,据题意推测NF3、F2、NO三种气体中,氧化性由弱到强的顺序为F2>NF3>NO.
(3)NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是产生红棕色气体,产生刺激性气味气体,产生白雾.
Ⅱ、纳米线四氧化三铁是应用最为广泛的软磁性材料之一,共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示,请回答下列问题:
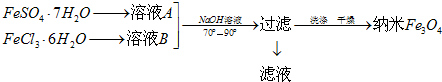
(4)实验室保存溶液A时,需加入铁粉、硫酸.为了得到较纯的纳米Fe3O4,理论上FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2.制备纳米Fe3O4的离子反应方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O.
(5)共沉淀法的主要不足是:
①得到的Fe3O4纳米粒子间存在团聚现象
②Fe2+易被氧化为Fe3+,很难控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品含有杂质.
(6)磁流体是电子材料的新秀,它是由直径为纳米量级(10纳米以下)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中不正确的是A.
A、纳米Fe3O4磁流体分散系属于溶液
B、纳米Fe3O4磁流体可以通过渗析法得到提纯
C、当一束可见光通过该磁流体时会出现光亮的通路
D、纳米Fe3O4磁流体比较稳定.
分析 (1)根据反应物、生成物书写方程式,该反应中N元素化合价由+3价变为+2价、+5价,根据硝酸和转移电子之间的关系式计算;
(2)根据氧化剂氧化性强于氧化产物氧化性分析;
(3)反应中生成NO,NO易与空气中氧气反应生成红棕色的NO2气体,同时形成酸雾;
(4)硫酸亚铁易被氧化为硫酸铁,硫酸亚铁为强酸弱碱盐,易发生水解,FeSO4•7H2O和FeCl3•6H2O在氢氧化钠溶液中生成四氧化三铁、水、氯化钠;根据电荷守恒可写出该方程式,根据方程式求解理论上FeSO4•7H2O和FeCl3•6H2O的物质的量之比;
(5)共沉淀法制备纳米级Fe3O4的关键为FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,Fe2+易被氧化为Fe3+,产品有杂质;
(6)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,所以应具备胶体的性质,根据胶体的性质分析.
解答 解:(1)由反应物和生成物可写出反应的化学方程式为3NF3+5H2O=2NO+HNO3+9HF,NF3→NO,化合价降低1价,被还原,NF3→HNO3,化合价升高2价,被氧化,由方程式可知若反应中生成0.2mol HNO3,转移的电子的物质的量为0.2mol×(5-3)=0.4mol,转移的电子数目为0.4NA个,
故答案为:3NF3+5H2O=2NO+HNO3+9HF;0.4NA;
(2)由4NH3+3F2=NF3+3NH4F可知氧化剂:F2、氧化产物:NF3,所以氧化性F2>NF3,由3NF3+5H2O=2NO+HNO3+9HF可知氧化剂:NF3、氧化产物:HNO3,硝酸氧化性强于NO,所以氧化性NF3>NO,则氧化性F2>NF3>NO,
故答案为:F2>NF3>NO;
(3)NO易与空气中氧气反应生成红棕色的NO2气体,同时生成的HF和HNO3易结合空气中的水蒸气形成酸雾,有刺激性气味,
故答案为:产生红棕色气体,产生刺激性气味气体,产生白雾;
(4)硫酸亚铁易被氧化为硫酸铁,常加入少量铁粉防止亚铁离子被氧化,加入硫酸防止其水解,生成Fe3O4的反应物为Fe2+、Fe3+和OH-,根据电荷守恒可写出该离子方程式为Fe2++2Fe3++8OH-=Fe3O4+4H2O,化学方程式为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,
故答案为:铁粉、硫酸;1:2;
(5)共沉淀法制备纳米级Fe3O4的反应为FeSO4•7H2O+2FeCl3•6H2O+8NaOH=Fe3O4↓+17H2O+Na2SO4+6NaCl,Fe2+易被氧化为Fe3+,无法控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品有杂质,
故答案为:Fe2+易被氧化为Fe3+,很难控制FeSO4•7H2O和FeCl3•6H2O的物质的量之比为1:2,产品含有杂质;
(6)根据题意磁流体分散系分散质粒子直径在10纳米以下,属于胶体的范畴,具备胶体的性质.
A.分散质粒子直径在10纳米以下,所得分散系为胶体,所以不是溶液,故A错误;
B.该分散性属于胶体,胶体可以通过渗析法得到提纯,故B正确;
C.该分散性属于胶体,胶体有丁达尔效应,所以当一束强光通过此磁流体时会出现光亮的通路,故C正确;
D.所得分散系为胶体,较稳定,属于介稳体系,故D正确;
故答案为:A.
点评 本题考查含氮、铁化合物的性质以及氧化还原反应,题目难度中等,注意从化合价变化的角度分析氧化还原反应的有关概念和计算,注意把握题给信息,为解答该题的关键.

 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,a中液体立即沸腾,并有红棕色蒸气出现;a中发生反应的化学方程式为:2Fe+3Br2═2FeBr3、
 ;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.
;继续滴加至液溴滴完.仪器a的名称是三颈烧瓶;装置d中的作用是吸收HBr气体.仪器c为冷凝管,其进水口为下(填“上”或“下”)口.(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸收其中的水分.
(3)经过上述分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C.
A.重结晶 B.过滤 C.蒸馏 D.萃取.
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | OH-+H+═H2O | B. | OH-+CO32-+2H+═HCO3-+H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
| 物质鉴定试验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为CO32-、OH-,C、D、E中含有的阳离子为H+、Al3+、Ag+ |
| ②A溶液与E溶液反应,既有气体产生又有沉淀产生,A与C反应只有气体产生 | A为Na2CO3,C含H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为AgNO3 |
(3)在100mL 0.1mol•L-1E溶液中,逐滴加入35mL 2mol•L-1NaOH溶液,写出发生反应的离子方程式2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O.
| A. | 4g 氦气中含有的分子数为NA | |
| B. | 常温常压下,22.4LCl2中含有的分子数为NA | |
| C. | 1L1mol/LK2SO4溶液中含有的钾离子数为NA | |
| D. | 1mol钠原子中含有的电子数为NA |
| A. | NH3+HCl═NH4Cl | B. | 2H2O═2H2+O2 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | C+H2O(g)═CO+H2 |
 按要求完成下列填空:
按要求完成下列填空: