题目内容
18.55g铁铝混合物与足量的盐酸反应生成标准状况下的氢气44.8L,则混合物中铁和铝的物质的量之比为( )| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 2:3 |
分析 铁、铝混合物与足量的盐酸反应,反应方程式分别为:Fe+2HCl=FeCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,根据质量和生成氢气的体积列方程组计算.
解答 解:标准状况下44.8L氢气的物质的量为:n(H2)=$\frac{44.8L}{22.4L/mol}$=2mol.
设混合物中含有Fe、Al的物质的量分别为xmol、ymol,
已知反应:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,则
Fe+2HCl=FeCl2+H2↑
x x
2Al+6HCl=2AlCl3+3H2↑
y $\frac{3}{2}$y
则有:$\left\{\begin{array}{l}{56x+27y=55}\\{x+\frac{3}{2}y=2}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.5}\\{y=1}\end{array}\right.$,
所以n(Fe):n(Al)=x:y=0.5mol:1mol=1:2,
故选B.
点评 本题考查混合物的计算,题目难度不大,注意根据反应的化学方程式结合固体的质量和生成氢气的体积列方程组计算即可解答,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
相关题目
8.下列各选项能说明分子式为C4H6的某烃是HC≡C-CH2-CH3,而不是CH2═CH-CH═CH2的事实是( )
| A. | 燃烧有浓烟 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 能与溴发生1:2加成反应 | |
| D. | 与足量溴水反应,生成物中只有2个碳原子上有溴原子 |
9.物质的熔沸点能用键能大小解释的是( )
| A. | H2O>H2S | B. | N2>O2 | C. | Na>K | D. | SiO2>CO2 |
13.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L的CCl4中含CCl4分子数为NA | |
| B. | 5.6g 铁和6.4g 铜分别与0.1mol 氯气完全反应,转移的电子数相等 | |
| C. | 0.1mol•L-1MgCl2溶液中含Cl-数为0.2NA | |
| D. | 3.9g Na2O2晶体中含有的离子总数为0.2NA |
3.下列各组多电子原子的原子轨道能量高低比较中,错误的是( )
| A. | 3px<3py | B. | 2s<2p | C. | 3s<3d | D. | 4s>3p |
10.下列说法正确的是( )
| A. | 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子 | |
| B. | 2H既可表示2个氢原子,又可表示2mol氢原子 | |
| C. | 1mol氯含有6.02×1023个电子 | |
| D. | 阿伏伽德罗常数数值近似值为6.02×1023 |
10.下列叙述正确的是( )
| A. | NaCl溶液在电流的作用下电离出Na+ | |
| B. | Na可以在氯气中燃烧,会冒白烟,火焰为黄色 | |
| C. | 氨水呈弱碱性,故NH3是弱电解质 | |
| D. | 溶于水电离出氢离子的化合物都是酸 |
 ,食醋中的有机物结构式
,食醋中的有机物结构式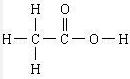 ,乙烯水化法所得产物的结构简式CH3CH2OH.
,乙烯水化法所得产物的结构简式CH3CH2OH. 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.