题目内容
某同学为了使反应2HCl+2Ag=2AgCl+H2↑能进行,设计了如下图所示的四个实验,你认为可行的方案关于下列各装置图的叙述中,正确的是( )
分析:2HCl+2Ag=2AgCl+H2↑不能自发的进行氧化还原反应,要使该反应发生只能设计成电解池,且银作阳极,盐酸作电解质溶液,据此分析解答.
解答:解:2HCl+2Ag=2AgCl+H2↑不能自发的进行氧化还原反应,要使该反应发生只能设计成电解池,该反应中银失电子发生氧化反应,则银作阳极,该电解质溶液为盐酸,阴极上氢离子得电子发生还原反应,
A.银作负极,不符合题意,故A错误;
B.该装置中铁易失电子作负极而不是银作负极,故B错误;
C.银作阳极,电解质溶液为盐酸,符合题意,故C正确;
D.该装置不能自发的进行氧化还原反应,所以不能设计成原电池,故D错误;
故选C.
A.银作负极,不符合题意,故A错误;
B.该装置中铁易失电子作负极而不是银作负极,故B错误;
C.银作阳极,电解质溶液为盐酸,符合题意,故C正确;
D.该装置不能自发的进行氧化还原反应,所以不能设计成原电池,故D错误;
故选C.
点评:本题考查了原电池和电解池原理,明确“不能自发进行的氧化还原反应必须设计成电解池才能发生”是解本题关键,再结合得失电子的物质分析解答,难度中等.

练习册系列答案
相关题目
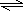 Cu(OH)2+2H+
Cu(OH)2+2H+ (2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
(2012?朝阳区二模)氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3?6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):


