题目内容
【题目】已知一定温度下:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1 ②N2(g)+3H2(g)![]() 2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
2NH3(g) ΔH2=-92.4 kJ·mol-1 ③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1下列说法正确的是( )
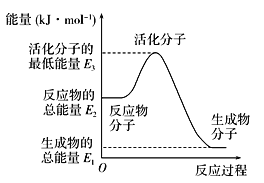
A. 反应②中的能量变化如上图所示,则ΔH=E1-E3
B. 2 mol H2(g)完全燃烧生成液态水时放出的热量小于483.6 kJ
C. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D. 氨催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
【答案】C
【解析】
A.反应热等于生成物的总能量-反应物的总能量,因此△H2=E1﹣E2,A错误;
B.已知:2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1;H2O(g)= H2O(l) ΔH<0。所以2 mol H2(g)完全燃烧生成液态水时放出的热量大于483.6 kJ,B错误;
C.在恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为Q1kJ,若通入2molN2和6molH2,相当于加压,平衡右移,Q2>2Q1,92.4 kJmol﹣1为生成2mol氨气时放出的热量,可逆反应不能进行到底,因此184.8>Q2>2Q1,C正确;
D.已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJmol﹣1②N2(g)+3H2(g)≒2NH3(g)△H2=﹣92.4kJmol﹣1③2H2(g)+O2(g)═2H2O(g)△H3=﹣483.6kJmol﹣1,由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906 kJmol﹣1,D错误;
综上所述,本题选C 。