题目内容
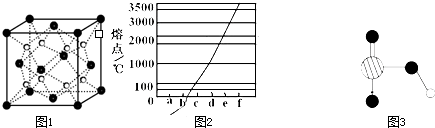
图一是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.

(1)请写出图中d单质对应元素原子的电子排布式______.
(2)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含______个δ键和______个π键.
(3)a与b的元素形成的10电子中性分子X的空间构型为______;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为______,其中X与Ag+之间以______键结合.
(4)图二是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因______.

(1)请写出图中d单质对应元素原子的电子排布式______.
(2)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含______个δ键和______个π键.
(3)a与b的元素形成的10电子中性分子X的空间构型为______;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络离子的化学式为______,其中X与Ag+之间以______键结合.
(4)图二是上述六种元素中的一种元素形成的含氧酸的结构:请简要说明该物质易溶于水的两个数原因______.
(1)d为Cu,是29号元素,原子的电子排布式为1s22s22p63s23p63d104s1.
故答案为:1s22s22p63s23p63d104s1.
(2)由图一单质的熔点高低的顺序可知a为氢气,f为碳单质.对应的元素以原子个数比1:1形成的分子为乙炔.
乙炔分子中含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键.
故答案为:3; 2
(3)X为氨气,空间构型为三角锥型.氨气与AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+.
故答案为:三角锥形;[Ag(NH3)2]+,配位
(4)该酸为HNO3,HNO3是极性分子,易溶于极性的水中;
并且HNO3分子中的-OH易与水分子之间形成氢键,易溶于水.
故答案为:HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子之间形成氢键.
故答案为:1s22s22p63s23p63d104s1.
(2)由图一单质的熔点高低的顺序可知a为氢气,f为碳单质.对应的元素以原子个数比1:1形成的分子为乙炔.
乙炔分子中含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键.
故答案为:3; 2
(3)X为氨气,空间构型为三角锥型.氨气与AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+.
故答案为:三角锥形;[Ag(NH3)2]+,配位
(4)该酸为HNO3,HNO3是极性分子,易溶于极性的水中;
并且HNO3分子中的-OH易与水分子之间形成氢键,易溶于水.
故答案为:HNO3是极性分子,易溶于极性的水中;HNO3分子中的-OH易与水分子之间形成氢键.

练习册系列答案
 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
下列各组物质依次表示为a、b、c、d,图中箭头表示一步转化.满足如图转化关系的是( )

| A、Na Na2O2 NaOH Na2CO3 | B、S SO2 H2SO3 NaHSO3 | C、Cu CuO Cu(OH)2 CuSO4 | D、Si SiO2 H2SiO3 Na2SiO3 |
(1)0.1mol/L Na2CO3溶液呈 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式 。
(3)某温度下的水溶液中,c(H+)=10-xmol/L,
c(OH-)=10-y mol/L。x与y的关系如右图所示:
该温度下水的离子积为 ;该温度下0.01 mol/L NaOH溶液的pH为 。
(4)如右图装置,已知两电极上发生的电极反应分别为:a极:Cu2++2e-= Cu
b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有 (填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |
 Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃ 时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到 mol·L一1  (1)0.1mol/LNa2CO3溶液呈
(1)0.1mol/LNa2CO3溶液呈