题目内容
8.相同条件下,某甲烷与乙烯混合气体相对氢气的密度为11,则混合气体中甲烷的质量百分数约是( )| A. | 50% | B. | 36% | C. | 64% | D. | 45% |
分析 相同条件下,某甲烷与乙烯混合气体相对氢气的密度为11,则混合气体的摩尔质量为22g/mol,以此计算物质的量之比,可计算质量分数.
解答 解:相同条件下,某甲烷与乙烯混合气体相对氢气的密度为11,则混合气体的摩尔质量为2g/mol×11=22g/mol,
设混合气体中甲烷的物质的量为xmol、乙烯的物质的量为ymol,则:$\frac{16x+28y}{x+y}$=22,整理可得x:y=1:1,
则乙烯的质量分数为$\frac{1×28}{1×16+1×28}$≈64%.
故选C.
点评 本题考查混合物的计算,关键是计算混合气体的平均摩尔质量,侧重于学生的分析计算能力的考查.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
18.某氯原子的质量为a g,12C原子的质量为b g,用NA表示阿伏加德罗常数的值,下列说法中不正确的是( )
| A. | 氯原子的相对原子质量一定是$\frac{12a}{b{N}_{A}}$ | |
| B. | xg该氯原子物质的量一定是$\frac{x}{a{N}_{A}}$mol | |
| C. | 1mol该氯原子的质量是aNAg | |
| D. | yg该氯原子所含的氯原子数为$\frac{y}{a{N}_{A}}$ |
19.某溶液能溶解Al(0H)3,则在其中一定可以大量存在的离子组是( )
| A. | Na+、SO${\;}_{4}^{2-}$、Cl- | B. | K+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Mg2+、SO${\;}_{4}^{2-}$、Br- | D. | NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、AlO${\;}_{2}^{-}$ |
16.在2L恒容容器中投入2mol X(g)、4mol Y发生如下反应:X(g)+Y(?)?3Z(g).测得X物质的量与时间关系如下表所示:下列说法正确的是( )
| 时间/min | 1 | 2 | 4 | 6 | 8 |
| X物质的量/mol | 1.5 | 1.2 | 1.0 | 0.9 | 0.9 |
| A. | 增加Y的质量,反应速率一定加快 | |
| B. | 0~4min段Z的平均速度为$\frac{3}{8}$mol•L-1•min-1 | |
| C. | 2~4min段X的平均速度为$\frac{1}{10}$mol•L-1•min-1 | |
| D. | X、Y的反应速率一定相等 |
3.2013年4月,俄罗斯公布了5个新探月计划,欲延续苏联时代辉煌.月球的土壤中吸附着数百万吨的${\;}_{\;}^{3}$He,每百吨${\;}_{\;}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量. 下列说法中正确的是( )
| A. | ${\;}_{\;}^{3}$He原子中的质子在原子核外空间内一定轨道上绕核高速运动 | |
| B. | ${\;}_{\;}^{3}$He原子不是微小的实心球体 | |
| C. | ${\;}_{\;}^{3}$He原子是不能再分的微粒 | |
| D. | ${\;}_{\;}^{3}$He的最外层电子数为2,故${\;}_{\;}^{3}$He具有较强的金属性 |
3.实验室中用苯甲醛制备苯甲醇和苯甲酸.
已知:①制备原理为:
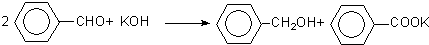
②有关物质的性质如表:
③醛可以与饱和NaHSO3溶液反应生成难溶于有机物而易溶于水的钠盐.
④纯净的液态有机物一般都有固定沸点.
制备苯甲醇和苯甲酸的主要过程如图:

(1)操作I的名称是分液.操作II的名称是蒸馏.
(2)操作III的名称是过滤,产品乙是苯甲酸.
(3)某同学测定产品甲的沸点,发现其在190℃即开始沸腾.该同学推测产品甲是苯甲醇与苯甲醛的混合物,设计了如下方案进行检验和提纯,结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取7.00g产品甲,加入足量银氨溶液充分反应,生成单质Ag 2.16g.则产品甲中苯甲醇的质量分数的计算表达式为:$\frac{7.00g-\frac{2.16g}{108g/mol}×\frac{1}{2}×106g/mol}{7.00g}$100%,
计算结果为84.9%(保留三个有效数字.苯甲醛相对分子质量:106;Ag:108).
已知:①制备原理为:

②有关物质的性质如表:
| 物质 | 沸点 | 熔点 | 溶解性 |
| 苯甲醛 | 179℃ | -26℃ | 微溶于水,能与乙醚混溶. |
| 苯甲醇 | 205.3℃ | -15.3℃ | 稍溶于水,能与乙醚混溶 |
| 苯甲酸 | 249℃ | 122℃ | 微溶于水,易溶于乙醚. |
| 乙醚 | 34.8℃ | 难溶于水 |
④纯净的液态有机物一般都有固定沸点.
制备苯甲醇和苯甲酸的主要过程如图:

(1)操作I的名称是分液.操作II的名称是蒸馏.
(2)操作III的名称是过滤,产品乙是苯甲酸.
(3)某同学测定产品甲的沸点,发现其在190℃即开始沸腾.该同学推测产品甲是苯甲醇与苯甲醛的混合物,设计了如下方案进行检验和提纯,结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| 步骤① | 取少量产品甲于洁净的试管中,再加入2mLAg(NH3)OH 溶液,水浴加热. | 试管内壁产生光亮银镜 | 产品甲中含有苯甲醛 |
| 步骤② | 将少量产品甲置于分液漏斗中,然后向漏斗中加入饱和NaHSO3溶液,溶液,充分反应后分液. | ||
| 步骤③ | 将步骤②的有机层洗涤、干燥后,测定产品的 沸点 | 沸点为205.3℃ | 所得有机层是纯净的苯甲醇 |
计算结果为84.9%(保留三个有效数字.苯甲醛相对分子质量:106;Ag:108).
4.一种从植物中提取的天然化合物α-damascone可用于制作香水,其结构为: ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )
 ,有关该化合物的下列说法不正确的是( )
,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H20O | |
| B. | 该化合物中含有一个手性碳原子 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 所有碳原子可能在一个平面上 |