题目内容
7.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域.在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C $\stackrel{高温}{?}$2AlN+3CO下列叙述正确的是( )| A. | 在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 | |
| B. | 上述反应中每生成2molAlN,N失去6mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3 | |
| D. | 氮化铝的摩尔质量为41g/mol |
分析 Al2O3+N2+3C $\stackrel{高温}{?}$2AlN+3CO中,C元素的化合价升高,N元素的化合价降低,以此来解答.
解答 解:A.C为还原剂,N2为氧化剂,故A错误;
B.上述反应中每生成2molAlN,由N元素的化合价降低可知,N得到6mol电子,故B错误;
C.氮化铝中,Al为+3价,由化合物中正负化合价的倒数和为0可知氮元素的化合价为-3,故C正确;
D.摩尔质量与相对分子质量的数值相同,单位不同,摩尔质量的单位为g/mol,则氮化铝的摩尔质量为41g/mol,故D正确;
故选CD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意元素化合价的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17. 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:
请回答下列问题:
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为: ,空间构型为:三角锥形.
,空间构型为:三角锥形.
(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
 现有部分元素的存在、性质或原子结构如表所示:
现有部分元素的存在、性质或原子结构如表所示:| A | 最外层电子数是次外层电子数的2倍的元素 |
| B | 最高正价为+7价的短周期元素 |
| C | 最外层电子数等于电子层数的短周期元素 |
| D | 地壳中含量居第二位的金属元素 |
| E | 其氢化物在同主族元素氢化物中熔沸点最高 |
| F | 短周期元素中原子半径(除稀有气体外)最大的元素 |
(1)写出由上述条件可以确定的元素的元素符号:C、Cl、Fe、Na.
(2)若E的气态氢化物能与E的最高价氧化物对应的水化物发生化合反应生成离子化合物,则E的气态氢化物的电子式为:
 ,空间构型为:三角锥形.
,空间构型为:三角锥形.(3)已知由至少满足表中一项条件的元素所组成的高中常见的物质之间可以发生如下图所示的转化关系.其中甲、乙、丙为含有同一种元素的纯净物(反应条件略).
若X为非金属元素的单质,图中反应均为氧化还原反应,则X为C(填化学式),反应Ⅲ的化学方程式为2CO+O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2.
18.原子序数依次增大的四种短周期元素X、Y、Z、W,X与Z同主族且X最外层电子比次外层电子多2个,Y元素的周期序数等于族序数,W元素的最高正价与最低负价代数和为4,下列说法错误的是( )
| A. | 最高价氧化物对应水化物的酸性:W>X>Z>Y | |
| B. | 氢化物的稳定性:X>Z | |
| C. | Y单质可用于钢轨的焊接 | |
| D. | 原子半径大小顺序:X<Y<Z<W |
15.在原子序随着卤素原子核电荷数的增加,下列递变规律正确的是( )
| A. | 单质的熔沸点逐渐降低 | B. | 气态氢化物的稳定性逐渐降低 | ||
| C. | 卤素最高价含氧酸酸性逐渐增强 | D. | 卤素单质的氧化性逐渐增强 |
2.在苯的同系物中,加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是( )
| A. | 苯的同系物分子中,碳原子数比苯多 | |
| B. | 苯环受侧链影响,易被氧化 | |
| C. | 侧链受苯环影响,易被氧化 | |
| D. | 分子中含有碳碳双键的缘故 |
12.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述错误的是( ) 

| A. | 可以和溴水反应 | |
| B. | 可用有机溶剂萃取 | |
| C. | 分子中的官能团有羟基、酯基、醚键、羰基、碳碳双键、苯环 | |
| D. | 1mol维生素P可以和4molNaOH反应 |
19.下列关于溶液中离子的说法正确的是( )
| A. | 0.1 mol•L-1的Na2CO3溶液中离子浓度关系:c (Na+)+c (H+)=c (CO32-)+c (HCO3-)+c (H2CO3) | |
| B. | 0.1 mol•L-1的NH4Cl和0.1 mol•L-1的NH3•H2O等体积混合后溶液中的离子浓度关系:c (Cl-)>c (NH4+)>c (H+)>c (OH-) | |
| C. | 常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系:c (Na+)=c (CH3COO-) | |
| D. | 0.1 mol•L-1的NaHCO3溶液中离子浓度关系:c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
16.下列仪器装置的使用正确且能达到相应实验目的有 ( )
| A. | 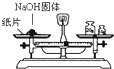 用托盘天平快速称量一定质量的氢氧化钠固体 | |
| B. |  使用橡皮管能使漏斗中的水顺利流下 | |
| C. |  分离Cl2与KI溶液反应生成的碘 | |
| D. |  分离Cl2与KI溶液反应生成的碘 | |
| E. |  比较Na2CO3和NaHCO3的热稳定性 | |
| F. |  用焰色反应检验钾离子 |
 ;请写出该反应的一个重要用途:焊接钢轨.
;请写出该反应的一个重要用途:焊接钢轨.