题目内容
(1)为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如图1所示的实验装置:
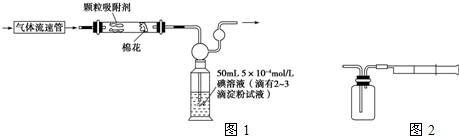
注:气体流速管是用来测量单位时间内通过气体的体积的装置
①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3?min-1)外,还需要测定
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度.请你协助甲同学完成100mL 5×10-4mol?L-1碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中,
第二步:
第三步:从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线.
(2)乙同学拟用如图1简易装置测定空气中的SO2含量:准确移取50mL 5×10-4 mol?L-1的碘溶液,注入如图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色.在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n).
①假设乙同学的测量是准确的,乙同学抽气的次数至少为
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设溶液配制、称量或量取及各种读数均无错误)提出两种合理假设:
③丙同学认为:乙同学的实验方案需要抽气的次数太多,操作麻烦.与乙讨论后,决定将抽气次数降到100次以下,请你设计合理的改进方案:
(2)二氧化硫用碘溶液来吸收,方程式为:SO2+I2+2H2O═2HI+H2SO4,结合反应的方程式计算,为减少实验误差,应减少碘溶液浓度或缩小容器体积.
②由题意可知碘单质微溶于水,KI可以增大碘在水中的溶解度,则准确称取1.27g碘单质加入烧杯中,同时还应加入少量碘化钾固体,加适量水搅拌使之完全溶解,
n(I2)=
| 1.27g |
| 254g/mol |
而配制100mL 5×10-4mol?L-1碘溶液,
则第二步操作应将第一步所得溶液全部转入1000 mL的容量瓶中,定容,摇匀,浓度为5×10-3mol?L-1,
则从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线,可得浓度为5×10-4mol?L-1碘溶液,
故答案为:同时加入少量碘化钾固体,加适量水搅拌使之完全溶解;将第一步所得溶液全部转入1000 mL的容量瓶中,定容,摇匀;
(2)①二氧化硫用碘溶液来吸收,方程式为:SO2+I2+2H2O═2HI+H2SO4,为说明该地空气中的SO2含量符合排放标准,
设至少抽气x次,则抽气x次SO2的质量为100x×10-3L×2×10-5 g?L-1=(2x×10-6)g,则根据化学方程式可得出结论.
SO2~~~~~~~~~~~I2
64 g 1 mol
2x×10-6 g 50×10-3 L×5×10-4 mol?L-1
x=800,
故答案为:800;
②如果乙同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,可能原因为抽气速度过快,二氧化硫没有充分被吸收,或者装置气密性较差等原因,
故答案为:抽气速度过快;装置气密性较差;
③决定将抽气次数降到100次以下,应减少碘溶液浓度或缩小容器体积,可用试管代替,以保证气体能充分反应,
故答案为:将50 mL 5×10-4 mol?L-1的碘溶液的体积减小为5 mL,并将广口瓶改为试管.

| |||||||||||||||





