题目内容
【题目】下列有关实验原理或操作正确的是( )
A. 选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO 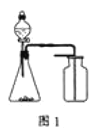
B. 除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干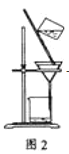
D. 用广泛pH试纸测得0.1molL-1NH4Cl溶液的pH=5.2
【答案】B
【解析】
A、由于一氧化氮能够与空气中的氧气反应生成二氧化氮,所以不能够使用排空气法制取一氧化氮,一般采用排水法收集NO;故A错误;
B、由于二氧化硅与盐酸不反应,且不溶于水,碳酸钙能够与盐酸反应,所以能够用稀盐酸除去二氧化硅中混有的碳酸钙,故B正确;
C、洗涤时不能用玻璃棒搅拌,否则易损坏滤纸而过滤失败,故C错误;
D、广泛pH试纸测定溶液的酸碱性,读数只能是整数,不可能是5.2,故D错误;
答案选B。

【题目】某校化学实验小组在“探究碘水与FeCl2溶液能否反应”的系列实验中发现:在足量的稀KI溶液中,加入1~2滴FeCl3溶液,振荡后溶液呈黄色。
(查阅资料)
碘微溶于水,碘的水溶液颜色随浓度变化呈现黄色或棕色,碘水中含有碘单质;含Fe3+的溶液也呈黄色。
(提出问题)
Fe3+、I2的氧化性强弱情况。
(提出猜想)
(1)甲同学认为氧化性I2>Fe3+,故上述实验现象不是发生化学反应所致,则溶液呈黄色是因为含______;乙同学认为氧化性Fe3+>I2,故上述实验现象是发生化学反应所致,则溶液呈黄色是因为含_______。
(设计实验并验证)
(2)为验证乙同学的观点正确,丙同学选用下面所提供的试剂设计出以下两种方案进行实验,请完成下列表格。供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
试剂 | 实验现象 | |
方案1 | ____________ | ______ |
方案2 | ______ | _________ |
(实验结论)
氧化性:Fe3+>I2。
(拓展应用)
(3)①根据上述实验推测,若在FeI2溶液中通入氯气,首先被氧化的离子是________。
②在100mL FeI2溶液中通入2.24LCl2(标准状况下),溶液中若有![]() 的Fe2+ 被氧化,用离子方程式表示该反应过程:___。
的Fe2+ 被氧化,用离子方程式表示该反应过程:___。


