��Ŀ����
����Ŀ���ӷ�ú�ң���Ī��ʯ��ʯӢ�ȣ��л���![]() ��һ�ֹ�����������:
��һ�ֹ�����������:
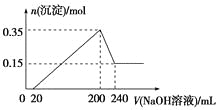
��1������Ӧ��I��ʹĪ��ʯ��ʯӢת��Ϊ![]() ��������ƣ���______________������ʮ���ƣ��ѧʽ�����Ӷ�ʹ���е�
��������ƣ���______________������ʮ���ƣ��ѧʽ�����Ӷ�ʹ���е�![]() �õ����
�õ����
��2����������������Ӧ��I�ս�������������Ҫ��е�ӹ����ɱ�ɷ�ĩ�����Էۻ�����������_______��
��3����ȡ���У���������![]() ��Һ��Ͷ�ϣ���������������ת��Ϊ
��Һ��Ͷ�ϣ���������������ת��Ϊ![]() �IJ��ʣ���ԭ����_______________________________________��ͬʱ������������ȡ������Ĵ�����ʽ��________________________________���ѧʽ����
�IJ��ʣ���ԭ����_______________________________________��ͬʱ������������ȡ������Ĵ�����ʽ��________________________________���ѧʽ����
��4����Ӧ�����з�����Ӧ�����ӷ���ʽΪ��__________________________________��
��5����Ӧ������ȡ���շ�����_____________________���������������п���ѭ��ʹ�õ�������_______________________________���ѧʽ����
���𰸡�![]() ����
����![]() �� ����Ҫ�ٷ�ĥ����ʡ���� ������̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������
�� ����Ҫ�ٷ�ĥ����ʡ���� ������̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������![]() �����ƶ�
�����ƶ� ![]()
![]() ���±���
���±��� ![]() ��
��![]()
��������
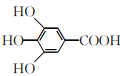
(1)����ʮ���ƻ�ѧʽ���չ�����Ƶ���ʽ������д��
(2) ���Էۻ����ǹ�����������Ҫ��е�ӹ����ɱ�ɷ�ĩ�����Խ�ʡ������
(3)��ȡ���У���������![]() ��Һ��Ͷ�ϣ���������������ת��Ϊ
��Һ��Ͷ�ϣ���������������ת��Ϊ![]() �IJ��ʣ���ԭ���ǹ�����̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������
�IJ��ʣ���ԭ���ǹ�����̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������![]() �����ƶ�����ȡ���й�Ĵ�����ʽ��
�����ƶ�����ȡ���й�Ĵ�����ʽ��![]() ��
��
(4)��Ӧ�����з���CO2��AlO2-�ķ�Ӧ��
(5)��Ӧ������ȡ���շ����Ǹ��±��գ�ʹ��������ת��Ϊ�����������ݹ��������������ģ����������ɵĽǶ��жϿ���ѭ��ʹ�õ����ʡ�
(1)����ʮ���ƻ�ѧʽΪ![]() (��
(��![]() )��
)��
(2) ���Էۻ����ǹ�����������Ҫ��е�ӹ����ɱ�ɷ�ĩ�����Խ�ʡ������
(3)��ȡ���У���������![]() ��Һ��Ͷ�ϣ���������������ת��Ϊ
��Һ��Ͷ�ϣ���������������ת��Ϊ![]() �IJ��ʣ���ԭ���ǹ�����̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������
�IJ��ʣ���ԭ���ǹ�����̼������Һ�����������ת��Ϊ̼��Ƴ������Ӷ�ʹƽ��������![]() �����ƶ�����ȡ���й�Ĵ�����ʽ��
�����ƶ�����ȡ���й�Ĵ�����ʽ��![]() ��
��
(4)��Ӧ�����з�����Ӧ�����ӷ���ʽΪ��![]() ��
��
(5)��Ӧ������ȡ���շ����Ǹ��±��գ�ʹ��������ת��Ϊ���������������������п���ѭ��ʹ�õ�������![]() ��
��![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���������ȣ�ClO2��������������֯��WHO���Ƽ���A1�����ס���ȫ����Ч��������������ClO2�������Ʊ�������
����һ��2NaClO3 + 4HCl �� 2ClO2��+ Cl2��+ 2NaCl + 2H2O
��������H2C2O4 + 2NaClO3 + H2SO4 �� Na2SO4 + 2CO2�� + 2ClO2�� + 2H2O
���������գ�
(1)�ڷ���һ�У�����0.2 mol���ӷ���ת��ʱ�����뷴Ӧ�Ļ�ԭ��Ϊ_________ mol��
(2)�ڷ������У���Ӧ��H2C2O4_________������ţ���
a������������ b���ȱ������ֱ���ԭ
c������������Ӧ d����δ������Ҳδ����ԭ
(3)���ַ�����ȣ�___________����д������һ�����������������Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ����______________________________________________��
(4)ʵ����Ҳ����������(NaClO3)����������(Na2SO3)�������ữ�������Ʊ��������ȣ��仯ѧ��Ӧ����ʽΪ ________________________________________________��
(5)��ԭ�Ӻ����______�ֲ�ͬ�˶�״̬�ĵ��ӣ������ӵ����������Ų�ʽ��________��
(6)CCl4���ӵĿռ乹��Ϊ__________________��CO2�ĵ���ʽ��___________________��
(7)��ͬѹǿ�£�����Ԫ���Ȼ�����۵������
�Ȼ��� | NaCl | KCl | CCl4 |
�۵�/�� | 804 | 773 | -22.92 |
�Խ��ͱ����Ȼ����۵�����ԭ��_______________________________________________________��
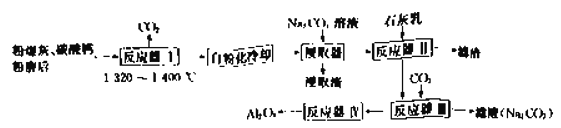
����Ŀ����������Ҫ�Ļ���ԭ�ϣ���ҽҩ��ұ�𡢻�����ʳƷ�����㷺ʹ�á�ijʵ��С���ͬѧģ���°��Ƽ��ȡ����������£�

��1����ҵ��������ĵ�һ���dz�ȥ����ʳ��ˮ����SO42-��Ca2+���ӣ����μ�����Լ�����������______________��_______________�����ˡ�_______________��
��2����֪�������ε��ܽ��
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
�ܽ�ȣ�20��C��100gH2Oʱ�� | 36.0 | 21.7 | 9.6 | 37.2 |
��д��װ��I�з�Ӧ�Ļ�ѧ����ʽ_____________________________________��
��д��װ��II�з�����Ӧ�Ļ�ѧ����ʽ________________________________��
��3���������п�ѭ�����õ�������__________________��
��4�����Ƴ��Ĵ�����ֻ��������NaCl��
�ټ����øô������Ƶ���Һ�к���Cl�D�ķ�����_________________________��
����m�˴�����Ʒ�м�������CaCl2��Һ�����������ˡ�ϴ�ӡ������������Ϊb g����ô���Ĵ��ȣ�����������Ϊ__________����m��b����ʾ����