题目内容
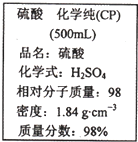
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2mol?L-1
B.1molZn与足量的该硫酸反应,标准状况下产生22.4L气体时,转移的电子数为NA
C.配制200mL4.6mol?L-1的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合后所得溶液的质量分数小于49%
【答案】分析:A、根据c= 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;
B、浓硫酸与锌反应生成的气体为二氧化硫,根据电子转移守恒可知锌与二氧化硫的物质的量相等,锌失去的电子即为反应转移的电子;
C、根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;
D、根据密度和体积计算溶液的总质量,根据硫酸的密度大于水的密度,判断质量分数关系.
解答:解:A、浓H2SO4的物质的量浓度c= mol/L=18.4mol/L,故A错误;
mol/L=18.4mol/L,故A错误;
B、Zn失2个电子形成锌离子,1molZn失去2mol电子,反应转移的电子为2NA;根据电子转移守恒可知,生成的二氧化硫的物质的量为1mol,标准状况下体积为22.4L,故B错误;
C、根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL×18.4mol/L=200mL×4.6mol/L,解得:x=50,所以应量取的浓硫酸体积是50mL,故C正确;
D、等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)= ×100%=
×100%= ×100%,因硫酸的密度大于水的密度,则ρ1<ρ2,所以
×100%,因硫酸的密度大于水的密度,则ρ1<ρ2,所以 ×100%>49%,故D错误.
×100%>49%,故D错误.
故选:C.
点评:本题考查溶液浓度的计算和大小比较,题目难度较大,注意硫酸的浓度越大,密度越大.
 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;B、浓硫酸与锌反应生成的气体为二氧化硫,根据电子转移守恒可知锌与二氧化硫的物质的量相等,锌失去的电子即为反应转移的电子;
C、根据溶液稀释前后溶质物质的量不变计算所需浓硫酸的体积;
D、根据密度和体积计算溶液的总质量,根据硫酸的密度大于水的密度,判断质量分数关系.
解答:解:A、浓H2SO4的物质的量浓度c=
 mol/L=18.4mol/L,故A错误;
mol/L=18.4mol/L,故A错误;B、Zn失2个电子形成锌离子,1molZn失去2mol电子,反应转移的电子为2NA;根据电子转移守恒可知,生成的二氧化硫的物质的量为1mol,标准状况下体积为22.4L,故B错误;
C、根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,则xmL×18.4mol/L=200mL×4.6mol/L,解得:x=50,所以应量取的浓硫酸体积是50mL,故C正确;
D、等体积混合,设体积分别为Vml,98%的H2SO4溶液密度为ρ1,水密度为ρ2,则混合后溶液的质量分数为w(H2SO4)=
 ×100%=
×100%= ×100%,因硫酸的密度大于水的密度,则ρ1<ρ2,所以
×100%,因硫酸的密度大于水的密度,则ρ1<ρ2,所以 ×100%>49%,故D错误.
×100%>49%,故D错误.故选:C.
点评:本题考查溶液浓度的计算和大小比较,题目难度较大,注意硫酸的浓度越大,密度越大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | B、取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸 | C、配制200mL4.6 mol?L-1的稀硫酸需取该硫酸50mL | D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol?L-1 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( ) 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.