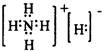题目内容
往下列物质的水溶液中,分别滴加稀硫酸和氯化铝溶液,均有可能产生白色沉淀的是( )
| A、BaCl2 | B、Ba(OH)2 | C、Na2CO3 | D、KOH |
分析:物质的水溶液中,分别滴加稀硫酸和氯化铝溶液,均有可能产生白色沉淀,说明该溶液中含有能和硫酸根离子反应生成沉淀的阳离子、能和铝离子反应生成沉淀的阴离子,据此判断该物质.
解答:解:A.氯化钡和硫酸反应生成硫酸钡白色沉淀,但和氯化铝不反应,故A错误;
B.氢氧化钡和硫酸反应生成硫酸钡白色沉淀,和氯化铝反应时,如果氢氧化钡少量就产生白色沉淀,当氢氧化钡过量时,沉淀转化为可溶性物质,故B正确;
C.稀硫酸和碳酸钠反应生成二氧化碳、硫酸钠和水,没有沉淀生成,氯化铝和碳酸钠反应生成氢氧化铝沉淀,故C错误;
D.氢氧化钾和硫酸发生中和反应生成可溶性的硫酸钾,所以没有沉淀生成,故D错误;
故选B.
B.氢氧化钡和硫酸反应生成硫酸钡白色沉淀,和氯化铝反应时,如果氢氧化钡少量就产生白色沉淀,当氢氧化钡过量时,沉淀转化为可溶性物质,故B正确;
C.稀硫酸和碳酸钠反应生成二氧化碳、硫酸钠和水,没有沉淀生成,氯化铝和碳酸钠反应生成氢氧化铝沉淀,故C错误;
D.氢氧化钾和硫酸发生中和反应生成可溶性的硫酸钾,所以没有沉淀生成,故D错误;
故选B.
点评:本题以物质间的反应为载体考查了物质的推断,根据生成物的溶解性来确定反应现象,易错选项是C,注意氯化铝和碳酸钠因为发生双水解反应而生成沉淀和气体,为易错点.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
(2010?潮州二模)根据下列实验内容得出的结论正确的是( )
|
根据下列实验内容得出的结论正确的是
| 选项 | 实 验 内 容 | 结 论 |
| A | 某物质的水溶液使红色石蕊试纸变蓝 | 该物质一定是碱 |
| B | 某气体能使湿润淀粉碘化钾试纸变蓝 | 该气体一定是氯气 |
| C | 某物质的水溶液中加入盐酸产生无色无味气体 | 该溶液一定含有碳酸根离子 |
| D | 往铁和稀硝酸反应后的溶液中滴入KSCN溶液,溶液显血红色 | 反应后溶液中肯定有Fe3+,可能还有Fe2+ |