��Ŀ����
���ݻ�Ϊ1L���ܱ������У�����1mol CO2��3mol H2�����¶�500��ʱ������Ӧ��CO2��g��+ 3H2��g��=CH3OH��g��+ H2O��g�� ��H<0��CH3OH��Ũ����ʱ��仯��ͼ������˵������ȷ����

- A.�ӷ�Ӧ��ʼ��10����ʱ��H2��ƽ����Ӧ����v(H2)��0.15 mol/(L��min)
- B.��20���ӵ�25���Ӵﵽ�µ�ƽ�⣬����������ѹǿ
- C.�����������䣬���¶�����800�棬�ٴδ�ƽ��ʱƽ�ⳣ����С
- D.�ӿ�ʼ��25���ӣ�CO2��ת������70%
����������ݻ�Ϊ1L������1mol CO2��3mol H2���ӷ�Ӧ��ʼ��10���ӣ�CH3OH��Ũ����10����Ϊ0.50mol/L����v(H2)��3 v(CH3OH)=3����0.50/10��="0.15" mol/(L��min)������A��ȷ��20���ӵ�25���Ӵﵽ�µ�ƽ�⣬��Ϊ��ߵĻ�ѧ������֮������ұߣ�����ѹǿ����CH3OH�ĺ������ߣ����ǵ�ѹǿ����Ũ��Ӧ�������������н�����̣�����B����Ϊ����Ĵ𰸣���Ϊ��H<0�����Ը÷�ӦΪ���ȷ�Ӧ�������¶�����ƽ��ʱƽ�ⳣ����С����CҲ��ȷ���ӿ�ʼ��25���ӣ�CO2��ת����=0.7/1��100%=70%����DҲ��ȷ�����Դ�ѡB��
���㣺��ѧƽ��
���������⿼���˻�ѧƽ����ƶ������ͼ�飬�Ǹ߿�������ȵ㣬������Ϣ�������Ѷ�Ҳ�ϴ�

��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ��ѧ����ʽΪ��
����ɲ���ƽ������ѧ����ʽ��������������
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g��?CH3OH��g����H1=-116kJ?mol-1
����֪��CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
���ʾ1mol��̬�״���ȫȼ������CO2��ˮ����ʱ���Ȼ�ѧ����ʽΪ
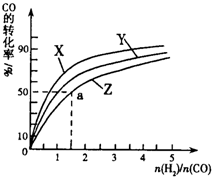
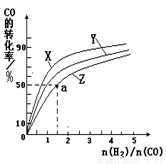
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250�桢270�������¶��ºϳɼ״��Ĺ��ɣ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��
��ش�
���������������¶��У�����Z��Ӧ���¶���
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO��g��+2H2��g��?CH3OH��g����ƽ�ⳣ��K=
����ij�¶��£���һ������CO��H2Ͷ��10L���ܱ������У�5minʱ�ﵽƽ�⣬�����ʵ����ʵ�Ũ�ȣ�mol?L-1���仯���±���ʾ��
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ�����룬����һ��ֵ���ڴ����µ����ʽ�������û�ѧ��Ӧԭ�������֪ʶ�о�̼���仯��������ʡ�
��1�����������ҹ���������̼���о�ȡ���ش��չ���õ绡���ϳɵ�̼�����г����д���̼�����������ʣ�������̼���������������������ᴿ���䷴Ӧ��ѧ����ʽΪ��
____C+____K2Cr2O7 + =___CO2��+ ____K2SO4 + ____Cr2��SO4��3+ ____H2O
����ɲ���ƽ������ѧ����ʽ��
������������________________������������_________________
��2���״���һ������ȼ�ϣ��״�ȼ�ϵ�ؼ�����ʵ��������ҵ����������ҵ��һ����CO��H2Ϊԭ�Ϻϳɼ״����÷�Ӧ���Ȼ�ѧ����ʽΪ��
CO��g��+ 2H2��g�� CH3OH��g�� ��H1=��116 kJ��mol��1
CH3OH��g�� ��H1=��116 kJ��mol��1
����֪�� ��H2=��283 kJ��mol��1
��H2=��283 kJ��mol��1
 ��H3=��242 kJ��mol��1
��H3=��242 kJ��mol��1
���ʾ1mol��̬�״���ȫȼ������CO 2��ˮ����ʱ���Ȼ�ѧ����ʽΪ ��
�����ݻ�Ϊ1L�ĺ��������У��ֱ��о���230�桢250��
270�������¶��ºϳɼ״��Ĺ��ɡ���ͼ�����������¶��²�ͬ��H2��CO����ʼ��ɱȣ���ʼʱCO�����ʵ�����Ϊ1mol����COƽ��ת���ʵĹ�ϵ��
��ش�:
���������������¶��У�����Z��Ӧ���¶��� ��
��������ͼ��a���Ӧ�����ݣ����������Z�ڶ�Ӧ�¶���CO(g)+ 2H2(g)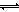 CH3OH(g)��ƽ�ⳣ��K=
��
CH3OH(g)��ƽ�ⳣ��K=
��
����ij�¶��£���һ������CO��H2Ͷ��10L���ܱ������У�5minʱ�ﵽƽ�⣬�����ʵ����ʵ�Ũ��(mol•L��1)�仯���±���ʾ��
|
|
0min |
5min |
10min |
|
CO |
0.1 |
|
0.05 |
|
H2 |
0.2 |
|
0.2 |
|
CH3OH |
0 |
0.04 |
0.05 |
��5min��10minֻ�ı���ijһ���������ı�������� �� �Ҹ��������ı������ ��