题目内容
|
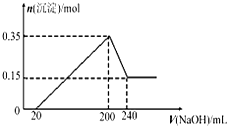
将一定质量的Mg和Al的混合物投入500 mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
则下列说法正确的是 | |
| [ ] | |
A. |
Mg和Al的总质量为8 g |
B. |
硫酸的物质的量浓度为5 mol·L-1 |
C. |
NaOH溶液的物质的量浓度为5 mol·L-1 |
D. |
生成的H2在标准状况下的体积为11.2 L |
答案:C
解析:
解析:
|
由图象可知,镁的物质的量为0.15 mol,铝的物质的量为0.2 mol,二者质量和为:27 g·mol-1×0.2 mol+24 g·mol-1×0.15 mol=9 g,A选项错误;生成气体的体积为:(0.2×1.5+0.15)mol×22.4 L·mol-1<11.2 L,因此D选项错误;镁离子和铝离子完全沉淀需氢氧化钠的物质的量为:0.15 mol×2+0.2 mol×3=0.9 mol,则氢氧化钠的浓度为:0.9 mol÷0.18 L=5 mol·L-1,C选项正确;当沉淀达最大量时,溶液中溶质为硫酸钠,根据硫酸根守恒得硫酸的浓度为:0.2 L×5 mol·L-1÷2÷0.5 L=1 mol·L-1,因此B选项错误. |

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示,则下列说法不正确的是( )| A、Mg和Al的总质量为9g | B、生成的H2在标准状况下的体积为11.2L | C、NaOH溶液的物质的量浓度为5mol/L | D、硫酸的物质的量浓度为1mol/L |

 将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体0待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( ) (2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
(2009?长春一模)将一定质量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( ) 将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
将一定质量的Mg和Al混合物投入500mL 稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )