题目内容
长期存放的亚硫酸钠部分可能会被氧化,现通过实验来测定某无水亚硫酸钠试剂的纯度。实验步骤如下:
①称量αg样品,置于烧杯中。
②加入适量蒸馏水,使样品溶解。
③加入稀盐酸,使溶液呈强酸性,再加过量的BaCl2溶液。
⑤加热干燥沉淀物。
⑥将沉淀物冷却至室温后,称量。
⑦重复⑤、⑥操作直到合格,最后得到bg固体。
回答下面问题:
(1)本实验中是否能用Ba(NO3)2代替BaCl2?_________.其理由是:_____________________.
(2)步骤③中加盐酸使溶液呈强酸性的目的是______________________________________________________________.
(3)步骤⑦的“合格”标准是______________________________________________________________.
(4)实验测得样品中无水亚硫酸钠的质量分数是____________________________.(列出算式,不需化简)
解析:
(1)不能;在酸性溶液中,NO3-能将SO32-氧化成SO42-,造成结果错误 (2)保证得到的沉淀都是BaSO4,没有BaSO3 (3)连续两次称量的质量不变 (4)
|
提示:
问题(1)的实质是离子共存问题的实际应用。在加盐酸使溶液呈强酸性后,虽有一部分SO32-变成SO2,但酸化时并未剧烈搅拌,也未加热,因此不可能使全部SO32-都变成SO2除去.如果加入过量Ba(NO3)2,溶液中的SO32-和大量的NO3-、H+不能共存,在强酸性条件下NO3-会将SO32-氧化成SO42-,造成最终测定结果偏低。步骤③中盐酸和BaCl2溶液的加入顺序并不会影响实验结果,但先加酸性溶液使其呈强酸性,可以使部分SO32-变成SO2,且在强酸性溶液中BaSO3不会沉淀,这样可以节省BaCl2试剂的用量,而且可以保证得到的沉淀都是BaSO4.这里考生如果只回答加酸是为了使SO32-转变成SO2是不完全的。步骤⑦的目的是为了检验BaSO4中的水分是否完全除去,如果沉淀完全干燥则重复⑤、⑥操作,两次称量的质量不会再改变(即在实验要求的误差范围内)。问题(4)的目的是考查考生对整个实验的目的、原理是否理解,关键是要懂得得到的BaSO4的摩尔数
即样品中Na2SO4的摩尔数.由此,样品中亚硫酸钠的质量分数是:
|

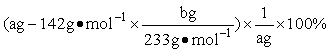

 长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案:
长期存放的亚硫酸钠可能会被空气中的氧气氧化.某化学兴趣小组通过实验来定性、定量测定亚硫酸钠试剂的被氧化的程度,设计如下方案: