题目内容
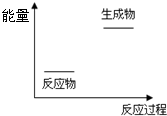
 根据如图提供的信息,下列所得结论正确的是( )
根据如图提供的信息,下列所得结论正确的是( )分析:A.根据反应物的总能量和生成物的总能量的相对大小来判断;
B.能量越低越稳定;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池;
D.放出的热量=反应物的总能量-生成物的总能量.
B.能量越低越稳定;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池;
D.放出的热量=反应物的总能量-生成物的总能量.
解答:解:A.若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量>生成物的总能量,则反应为吸热热反应,故该反应为放热反应,故A错误;
B.正反应是放热反应,生成物的能量比反应物的低,根据能量越低越稳定知生成物比反应物稳定,故B正确;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池,该反应是放热反应但不一定能自发发生,故C错误;
D.放出的热量=反应物的总能量-生成物的总能量=E1-E3,故D错误.
故选:B.
B.正反应是放热反应,生成物的能量比反应物的低,根据能量越低越稳定知生成物比反应物稳定,故B正确;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池,该反应是放热反应但不一定能自发发生,故C错误;
D.放出的热量=反应物的总能量-生成物的总能量=E1-E3,故D错误.
故选:B.
点评:本题考查吸热反应和放热反应,原电池和电解池的工作原理,化学反应中的能量变化,难度不大,学习中注意掌握原电池的工作原理.

练习册系列答案
相关题目
根据如图提供的信息,下列所得结论不正确的是( )


| A、反应物比生成物稳定 | B、该图可以表示石灰石高温分解 | C、该图可以表示断开反应物中的化学键吸收的能量大于形成生产物中的化学键放出的能量 | D、因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热 |
根据如图提供的信息,下列所得结论不正确的是( )


| A、该反应是吸热反应 | B、该反应反应物断裂旧键所吸收的能量高于生成物形成新键所放出的能量 | C、该反应可能是碳酸钙分解反应 | D、因为生成物的总能量高于反应物的总能量,所以该反应一定需要加热才能发生 |
 关于化学反应与能量的说法正确的是( )
关于化学反应与能量的说法正确的是( )