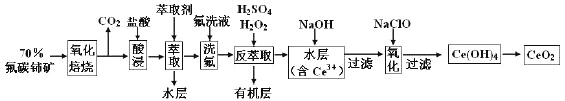
��Ŀ����
����Ŀ��I�����������ͼ��ʾת����ϵ�ش��й����⡣A��B��Ϊ���ε�ˮ��Һ��A�����ԣ�B�ʼ��Բ�����ǿ�����ԡ�
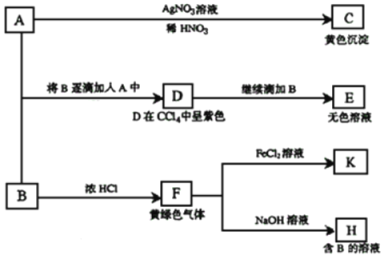
��1��д��A��B�Ļ�ѧʽ��A ��B ��
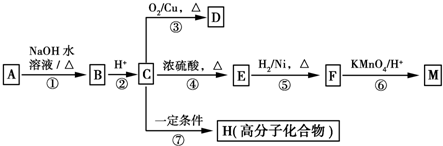
��2������д��A��D��D��E��E�к���ij+5��Ԫ�صĺ���������ӣ������ӷ���ʽ�� �� ��
��3��д����SO2����ͨ��K��Һ�з�����Ӧ�����ӷ���ʽ�� ��
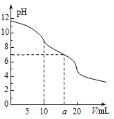
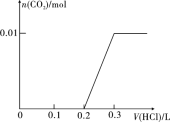
II����1����0.4gNaOH��1.06gNa2CO3��ϲ������Һ������Һ�еμ�0.1mol��L��1ϡ���ᡣ������ͼ��ʾ����ϵ�л�������ȷ��ʾ������������������CO2�����ʵ����Ĺ�ϵͼ��

��2����18.4gNaOH��NaHCO3����������ܱ������м��ȵ�Լ250��������ַ�Ӧ���ų����壬��ȴ���Ƶ�ʣ���������Ϊ16.6g���Լ���������NaOH����������������д��������̣�
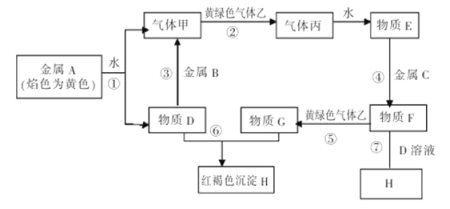
���𰸡�������1��NaI��NaClO��
��2��2I+ClO+H2O=I2+Cl+2OH�� I2+5ClO+2OH=2IO3-+5Cl+H2O����Ӧ��дˮ�ĸ�����
��3��2Fe3++SO32-+2H2O=2Fe2++SO42-+4H+����2Fe3++SO32-+H2O=2Fe2++SO42-+2H+����
������1����ͼ��ʾ
��2��54.3%��
��������
���������������1����A����C�õ���ɫ����AgI���ɵ�A�к���I����AΪ���Σ���AΪNaI����B��ŨHCl��Ӧ������F����ɫ����Ϊ���������Ե�BΪNaClO����2��NaI��NaClO����������Ӧ������DʹCCl4��Һ����ɫ��֤��D��I2�����ݵ����غ㡢����غ㼰ԭ���غ�ɵ�A��D�����ӷ���ʽΪ2I+ClO+H2O=I2+Cl+2OH������I2����Һ�м�������NaClO��Һ���ᷢ��������ԭ��Ӧ����I2����Ϊ��ɫ��IO3-�����ݵ����غ㡢����غ㼰ԭ���غ�ɵ�D��E�����ӷ���ʽΪI2+5ClO+ 2OH =2IO3-+5Cl+H2O����3��F��Cl2��������ͨ�뵽FeCl2��Һ�У�������Ӧ��Cl2+2FeCl2=2FeCl3������K��FeCl3��FeCl3���������ԣ�SO2���л�ԭ�ԣ����߷���������ԭ��Ӧ������SO2����ͨ��K��Һ�з�����Ӧ�����ӷ���ʽ��2Fe3++SO32-+H2O=2Fe2++SO42-+2H+��
��1��0.4g NaOH�����ʵ���Ϊn(NaOH)=m��M=0.4g��40g/mol=0.01mol��1.06g Na2CO3�����ʵ���Ϊn(Na2CO3)= m��M=0.01mol������ϲ������Һ������Һ�еμ�0.1mol��L1ϡ���ᣬ���ȷ���NaOH+ HCl=NaCl+H2O������HCl 0.01mol��Ȼ����Na2CO3+HCl=NaHCO3+NaCl������HCl 0.01mol�������NaHCO3+HCl=NaCl+CO2��+H2O������HCl 0.01mol�����������ݣ���������������������CO2�����ʵ����Ĺ�ϵͼ����
 ��
��
��2������NaOH��NaHCO3��1��1��Ӧ��
NaHCO3+NaOH ![]() Na2CO3+H2O�� ��m
Na2CO3+H2O�� ��m
84 40 18
8.4g 4.0g 18.4g16.6g=1.8g
8.4g+4.0g=12.4g��18.4g��˵����Ӧ���ǰ������������з�Ӧ��
��NaHCO3�������������Ȼᷢ���ֽ⣬���ֵ�������������ⲻ����
��NaOH�������������Ȳ���ֽ⣬��Ӱ�����ֵ���������⡣
������NaOH����Ϊ18.4g8.4g4g=6.0g��m(NaOH)=4.0g+6.0g=10.0g����NaOH����������=(10.0g��18.4g)��100%=54.3%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�