题目内容
5.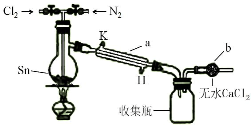 四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.
四氯化锡(SnCl4)在电子、化工等领域有重要用途.某兴趣小组拟用Sn和Cl2反应制备SnCl4.Ⅰ【查阅资料】
ⅰ.Sn的熔点为231℃,沸点为2260℃.
ⅱ.SnCl4在常温下为无色液体,沸点为114℃,极易水解,有弱氧化性,不能氧化I-和Fe2+.
Ⅱ【制备产品】
实验装置如图所示(省略夹持装置):
实验步骤:
ⅰ.检查装置的气密性.通入干燥的N2,排尽装置中的空气.
ⅱ.通入干燥的Cl2,加热,待Sn完全反应后,停止加热,改通N2.
ⅲ.待装置冷却到室温,取下收集瓶,密封备用.
请回答以下问题:
(1)Cl2可由MnO2与浓HCl混合加热制取,其化学方程式是MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O.
(2)仪器a的名称是冷凝管,冷却水入口是H(选填H或K);无水CaCl2的作用是防止水蒸气进入收集瓶使产物水解.
Ⅲ【探究与反思】
ⅰ.该小组讨论认为,本实验装置不完善,需要在仪器b后添加尾气吸收装置.
ⅱ.该小组讨论认为,产品中可能溶有Cl2.为验证此推测,取少量产品溶于盐酸中,分别进行了以下实验,请选取下列试剂完成实验2和3.
限选试剂:FeCl2溶液、CCl4、NaBr溶液、KI溶液、KSCN溶液、AgNO3溶液、淀粉溶液
| 实验内容 | 实验现象 | 结论 |
| 实验1:滴入KI溶液,再加淀粉溶液 | 溶液最终变为蓝色 | 产品中含有Cl2 |
| 实验2:① | ② | |
| 实验3:③ | ④ |
分析 (1)MnO2与浓HCl混合加热反应生成MnCl2、Cl2、H2O;
(2)仪器a为冷凝管,为充分冷却,采取逆流原理通入冷凝水;SnCl4极易水解,应在干燥环境下下进行制备,b装置作用是防止空气中的水蒸气加入收集瓶中;
Ⅲ.i.未反应的氯气直接排放,会污染空气,应添加盛放氢氧化钠溶液的洗气瓶吸收氯气;
ii.实验2:氯气具有强氧化性,可以将FeCl2氧化为FeCl3,再加入KSCN溶液检验;
实验3:氯气与NaBr溶液反应生成溴单质,再加入CCl4进行萃取检验.
解答 解:(1)MnO2与浓HCl混合加热反应生成MnCl2、Cl2、H2O,反应方程式为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O;
(2)由仪器结构特征,可知仪器a为冷凝管;为充分冷却,采取逆流原理通入冷凝水,即从冷凝管H口通入冷凝水;SnCl4极易水解,b装置中无水CaCl2可以防止水蒸气进入收集瓶使产物水解,
故答案为:冷凝管;H;防止水蒸气进入收集瓶使产物水解;
Ⅲ.i.未反应的氯气直接排放,会污染空气,需要在仪器b后添加尾气吸收装置,
故答案为:尾气吸收;
ii.实验2:加入FeCl2溶液,再加入KSCN溶液,溶液最终变为红色,说明产品中含有Cl2,
实验3:加入NaBr溶液,再加入CCl4,溶液分层,下层呈橙色,说明产品中含有Cl2,
故答案为:
| 实验内容 | 实验现象 | 结论 |
| 实验2:加入FeCl2溶液,再加入KSCN溶液 | 溶液最终变为红色 | |
| 实验3:加入NaBr溶液,再加入CCl4 | 溶液分层,下层呈橙色 |
点评 本题考查制备实验方案设计、对原理与装置的分析评价、物质检验方案设计等,注意阅读题目获取信息并迁移运用,难度中等.

练习册系列答案
相关题目
2.下列图象分别表示有关反应的反应过程与能量变化的关系( )

据此判断下列说法中正确的是( )

据此判断下列说法中正确的是( )
| A. | 石墨转变为金刚石是吸热反应 | |
| B. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)能量较高 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 |
7.反应CH3OH ( l )+NH3( g )═CH3NH2( g )+H2O ( g )在某温度自发向右进行,若反应|△H|=17kJ/mol,|△H-T△S|=17kJ/mol,对于该反应下列关系正确的是( )
| A. | △H>0,△H-T△S<0 | B. | △H<0,△H-T△S>0 | C. | △H>0,△H-T△S>0 | D. | △H<0,△H-T△S<0 |
17.3-氯戊烷是一种有机合成中间体,下列有关3-氯戊烷的叙述正确的是( )
| A. | 3-氯戊烷的分子式为C5H9Cl3 | B. | 3-氯戊烷属于烷烃 | ||
| C. | 3-氯戊烷能发生取代反应 | D. | 3-氯戊烷的同分异构体共有6种 |
14.食品的主要成分大都是有机化合物.下列食品中的有机成分属于高分子化合物的是( )
| A. | 食醋中含有的醋酸 | B. | 酒中含有的酒精 | ||
| C. | 葡萄中含有的葡萄糖 | D. | 谷类中含有的淀粉 |

 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义