题目内容
[化学一物质结构与性质]人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
(1)Cu的基态原子的电子排布式为 .
(2)Ti元素在元素周期表中的位置是第 周期第 族;其基态原子的价电子排布为 .
(3)据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
A.O2→2O B.O+H2O→2OH C.OH+OH→H2O2
B中破坏的是 (填“σ”或“π”)键.
(4)现代造纸工艺常用钛白粉(TiO2),钛白粉的一种工业制法是以钛铁矿(主要成分TiFeO3)为原料按下过程进行的.请配平下列化学方程式
① FeTiO3+ C+ Cl2
TiCl4+ FeCl3+ CO
②TiCl4+O2
TiO2+2Cl2
(5)Ti晶体的堆积方式是六方最密堆积,则晶体中Ti的配位数为 ,空间利用率为 .
(6)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结
构示意图如图所示,它的化学式是 ;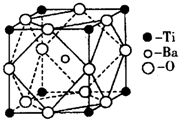
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关
实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
A.分别取等质量的两种配合物晶体的样品配成待测溶液;
B.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
C.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液与AgNO3溶液反应得到的沉淀质量的
.
则绿色晶体配合物的化学式为 ,绿色晶体中含有的化学键类型是 .
(1)Cu的基态原子的电子排布式为
(2)Ti元素在元素周期表中的位置是第
(3)据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
A.O2→2O B.O+H2O→2OH C.OH+OH→H2O2
B中破坏的是
(4)现代造纸工艺常用钛白粉(TiO2),钛白粉的一种工业制法是以钛铁矿(主要成分TiFeO3)为原料按下过程进行的.请配平下列化学方程式
①
| ||
②TiCl4+O2
| ||
(5)Ti晶体的堆积方式是六方最密堆积,则晶体中Ti的配位数为
(6)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结
构示意图如图所示,它的化学式是

②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关
实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
A.分别取等质量的两种配合物晶体的样品配成待测溶液;
B.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
C.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液与AgNO3溶液反应得到的沉淀质量的
| 2 |
| 3 |
则绿色晶体配合物的化学式为
考点:晶胞的计算,原子核外电子排布,配合物的成键情况,氧化还原反应方程式的配平
专题:化学键与晶体结构
分析:(1)Cu元素原子核外电子数为29,根据能量最低原理书写;
(2)钛元素是22号元素,以此确定位置,结合能量最低原理书写基态原子的电子排布式;
(3)由H2O→OH可知,水分子中O-H键被破坏;
(4)令FeTiO3的系数为1,根据原子守恒进行配平,再扩大相同倍数转化为整数;
(5)六方最密堆积,配位数为12,空间利用率为74%;
(6)①利用均摊法计算晶胞中各种原子的数目,据此确定化学式;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子.
(2)钛元素是22号元素,以此确定位置,结合能量最低原理书写基态原子的电子排布式;
(3)由H2O→OH可知,水分子中O-H键被破坏;
(4)令FeTiO3的系数为1,根据原子守恒进行配平,再扩大相同倍数转化为整数;
(5)六方最密堆积,配位数为12,空间利用率为74%;
(6)①利用均摊法计算晶胞中各种原子的数目,据此确定化学式;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
解答:
解:(1)Cu元素原子核外电子数为29,根据能量最低原理可知,其基态原子的电子排布式为:1s22s22p63S23p63d104s1,
故答案为:1s22s22p63S23p63d104s1;
(2)钛元素在周期表中的原子序数为22,位于第四周期第IVB族,基态原子的电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),22Ti元素基态原子的价电子层排布式为3d24s2,
故答案为:3d24s2;
(3)由H2O→OH可知,水分子中O-H键被破坏,单键为σ键,
故答案为:σ;
(4)令FeTiO3的系数为1,根据Ti原子守恒可知,TiCl4的系数为1,由Fe原子守恒可知FeCl3的系数为1,由O原子守恒可知CO的系数为3,根据C原子守恒可知C的系数为3,根据Cl原子守恒可知氯气的系数为
,同时扩大2倍,配平后方程式为:2FeTiO3+6C+7Cl2+6C
2TiCl4+2FeCl3+6CO,
故答案为:2,6,7;2,2,6;
(5)六方最密堆积,配位数为12,空间利用率为74%;
故答案为:12;74%;
(6)①晶胞中分摊的各种原子的数目之比Ba:Ti:O=1:(8×
):(12×
)=1:1:3,故化学式为:BaTiO3,
故答案为:BaTiO3;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2?H2O,含有离子键、共价键、配位键,
故答案为:[TiCl(H2O)5]Cl2?H2O;离子键、共价键、配位键.
故答案为:1s22s22p63S23p63d104s1;
(2)钛元素在周期表中的原子序数为22,位于第四周期第IVB族,基态原子的电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),22Ti元素基态原子的价电子层排布式为3d24s2,
故答案为:3d24s2;
(3)由H2O→OH可知,水分子中O-H键被破坏,单键为σ键,
故答案为:σ;
(4)令FeTiO3的系数为1,根据Ti原子守恒可知,TiCl4的系数为1,由Fe原子守恒可知FeCl3的系数为1,由O原子守恒可知CO的系数为3,根据C原子守恒可知C的系数为3,根据Cl原子守恒可知氯气的系数为
| 7 |
| 2 |
| ||
故答案为:2,6,7;2,2,6;
(5)六方最密堆积,配位数为12,空间利用率为74%;
故答案为:12;74%;
(6)①晶胞中分摊的各种原子的数目之比Ba:Ti:O=1:(8×
| 1 |
| 8 |
| 1 |
| 4 |
故答案为:BaTiO3;
②Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2?H2O;离子键、共价键、配位键.
点评:本题考查物质结构与性质,题目综合性较大,涉及核外电子排布、化学键、方程式配平、晶胞计算与晶体结构、配合物等,难度中等,注意识记常见晶胞结构,注意配合物内界与外界区别.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
下列有关描述所对应的化学用语正确的是( )
| A、Na2S的水解:S2-+2H2O?H2S+2OH- | ||||
| B、碳酸的电离方程式:H2CO3?2H++CO32- | ||||
C、 如图反应开始时的离子方程式:Cu+2H+
| ||||
| D、氢氧碱性燃料电池的负极反应式:H2-2e-=2H+ |
下列各组离子在溶液中,能大量共存的是( )
| A、Na+、NH4+、H+、Cl- |
| B、Al3+、K+、OH-、NO3- |
| C、Mg2+、H+、CO32-、SO42- |
| D、Fe2+、H+、Cl-、NO3- |
将a g氯酸钾充分加热分解(同时加入少量MnO2),得到标准状况下b L气体,残留物充分溶解后所得溶液中共有c个溶质离子.则阿伏加德罗常数(NA)可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列两种物质发生反应:①Na和O2;②AlCl3与氨水;③水玻璃与CO2;④Fe与Cl2;⑤Cu和HNO3,因反应物用量或反应条件的不同而生成不同产物的是( )
| A、①②③④⑤ | B、①②③⑤ |
| C、①②⑤ | D、①③⑤ |
在pH=x的下列电解质溶液中插入两只惰性电极,电解一段时间后测得溶液的pH<x,则该电解质可能是( )
| A、NaOH溶液 |
| B、AgNO3溶液 |
| C、NaCl溶液 |
| D、Na2SO4溶液 |
